
【题目】下列物质中属于电解质的是( )
A. NaOH溶液 B. K2SO4 C. CO2 D. Cu
科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量的说法中,不正确的是( )
A.氢氧化钠与盐酸的反应属于放热反应
B.能量变化是化学反应的基本特征之一
C.原电池是将电能转化为化学能的装置
D.反应物的总能量低于生成物的总能量,反应时从环境吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)
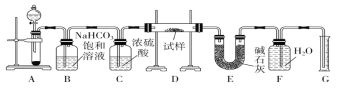
回答下列问题:
(1)实验前必须检查装置的气密性。仪器连接好后,在________中加适量的水,关闭A中分液漏斗阀门后微热试管,若看到________,说明装置气密性好。
(2)装置A中液体试剂选用盐酸而不是硫酸,理由是__________________________________________。
(3)装置B的作用是___________;装置C的作用是______________;装置E中碱石灰的作用是__________________。
(4)装置D中发生反应生成气体的化学方程式是_____________________________________________。
(5)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶炼金属铝的废弃物铝灰为原料制取超细![]() -氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
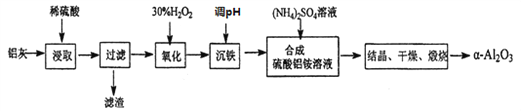
(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为____(填选项编号)。

(2)流程中加入H2O2 有气体产生,原因是_______________________________。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3。己知:
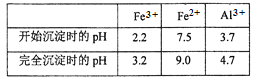
为保证产品的纯度,可以选用下列物质中的_______调节溶液pH(填字母),调节pH的范围为___________________________。
a.A12O3 b.NaOH c.Al(OH) 3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4 Al(SO4)2·12H2O] ![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
将产生的气体通过下图所示的装置:
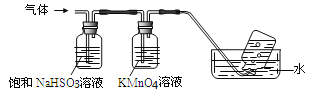
①集气瓶中收集到的气体是_____________________(填化学式);
②装有KMnO4溶液洗气瓶的作用是__________________________________;
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示装置,探究氯碱工业原理,下列说法正确的是

A. 石墨电极与直流电源负极相连
B. 铜电极的反应式为:2H2O+2e-![]() 2OH-+H2↑
2OH-+H2↑
C. 氢氧化钠在石墨电极附近产生, Na+ 向石墨电极迁移
D. 用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学方法区别NaCl、MgCl2、AlCl3、CuCl2、FeCl3和NH4Cl六种溶液(必要时可加热),下列试剂中可选用的是( )
A.KSCN溶液B.AgNO3溶液C.BaCl2溶液D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、碳氧化物是合成可再生能源甲醇的基础原料,具有重要的应用前景。
(1)已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1和890.0 kJ·mol-1。一定条件下,CO与H2合成甲烷的热化学方程式为:CO(g)+3H2(g)==CH4(g)+H2O(1)△H
则△H=________;该反应能自发进行的原因是_____________________________________。
(2)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
反应II:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①一定温度下,在体积可变的恒压密闭容器中加入4molH2和一定量的CO发生反应I,开始时容器体积为2L,CO和CH3OH(g)的浓度随时间变化如图1。10min达到平衡,则反应I的化学平衡常数为______________(结果保留一位小数)。
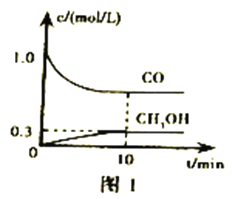
②恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,下列描述能说明反应II已经达到平衡状态的是________________(填序号)。
A.容器内CO2的体积分数不再变化 B.当CO2和H2转化率的比值不再变化
C.当水分子中断裂2NA个O-H键,同时氢分子中断裂3NA个H-H键
D.容器内混合气体的平均相对分子质量达到34.5,且保持不变
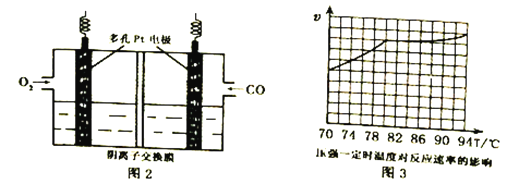
(3)用KOH作电解质的CO碱性燃料电池(如图2)作电源,用惰性电极电解含CN-废水,将CN-彻底氧化为无害气体,以净化废水。该电池的负极反应式为_____________;若开始时正、负两电极区溶液质量相等,当除去1molCN-时,理论上两电极区溶液的质量差为______g。
(4)工业上通过CO与甲醇制取甲酸甲酯,热化学方程式为:CO(g)+ CH3OH(g) ![]() HCOOCH3(g)△H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是__________________________。
HCOOCH3(g)△H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com