
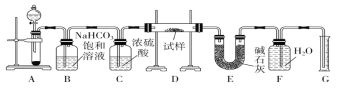
����Ŀ������һ��������Na2O���ʵ�Na2O2����������ͼ��ʵ��װ�òⶨNa2O2�����Ĵ��ȡ�(�ɹ�ѡ�õķ�Ӧ��ֻ��CaCO3���塢6 mol��L��1���ᡢ6 mol��L��1���������ˮ)
�ش��������⣺
(1)ʵ��ǰ������װ�õ������ԡ��������Ӻú���________�м�������ˮ���ر�A�з�Һ©�����ź����Թܣ�������________��˵��װ�������Ժá�
(2)װ��A��Һ���Լ�ѡ��������������ᣬ������__________________________________________��
(3)װ��B��������___________��װ��C��������______________��װ��E�м�ʯ�ҵ�������__________________��
(4)װ��D�з�����Ӧ��������Ļ�ѧ����ʽ��_____________________________________________��
(5)����ʼʱ�����Ʒ������Ϊ2.0 g����Ӧ���������������Ϊ224 mL(��״��)����Na2O2�����Ĵ���Ϊ_________��
���𰸡�F F�г�������ˮ������ ������CaCO3���巴Ӧ����CaSO4����ˮ���Ḳ����CaCO3������棬ʹ��Ӧ���ܳ������� ��ȥ�����е�HCl�� �������� ����װ��D�з�Ӧʣ���CO2 2Na2O2��2CO2===2Na2CO3��O2 78%
��������
ʵ��ԭ����ͨ���ⶨCO2��Na2O2��Ӧ���������������������������Na2O2������������ȡCO2�����õ���CaCO3������ķ�Ӧ������������лӷ��ԣ������ȡ��CO2�б�Ȼ����HCl������ͨ������NaHCO3��Һ��ȥ��װ��CΪ����CO2��װ��EΪ��ȥO2�к��е�CO2�����ݷ�Ӧ2Na2O2��2CO2===2Na2CO3��O2��Na2O2��O2�Ĺ�ϵ����������O2����������Ʒ��Na2O2�����������ȣ�n(O2)��0.01 mol��n(Na2O2)��0.01 mol��2��0.02 mol��w(Na2O2)����100%��78%��
(1) ���װ�õ������ԣ�Ӧ��װ�����Ӻ�֮�رջ������ˮ���װ���еĿ�����Ȼ����ü��ȷ�ʹװ��������ѹǿ����ͨ���ų�������γ�Һ���жϡ������������Ӻú���F�м�������ˮ���ر�A�з�Һ©�����ź����Թܣ�������F�г�������ˮ��������˵��װ�������Ժá�
�ʴ�Ϊ��F ��F�г�������ˮ��������
(2) ʵ��������CaCO3�����ᷴӦ��ȡCO2��������H2SO4��ԭ����H2SO4��CaCO3��Ӧ���ɵ�CaSO4�ܽ�Ƚ�С���Ḳ����CaCO3������棬��ֹ��Ӧ�ļ������С�
�ʴ�Ϊ��������CaCO3���巴Ӧ����CaSO4����ˮ���Ḳ����CaCO3������棬ʹ��Ӧ���ܳ������У�
(3) ̼��ƺ����ᷴӦ���ɵĶ�����̼�����к����Ȼ������壬�����ñ���̼����������ȥ��Ũ���������ˮ�ԣ����Խ�������̼���װ��E�м�ʯ�ҵ����������ն�����̼����ֹ�����������������ɸ��ţ�
�ʴ�Ϊ����ȥ�����е�HCl���������壻����װ��D�з�Ӧʣ��Ķ�����̼��
(4) װ��D���ǹ������ƺͶ�����̼������̼���ƺ������������ƺͶ�����̼��Ӧ����̼���ƣ�����������Ļ�ѧ����ʽΪ��2Na2O2��2CO2===2Na2CO3��O2��
�ʴ�Ϊ��2Na2O2��2CO2===2Na2CO3��O2��
(5)���ݷ�Ӧ2Na2O2��2CO2===2Na2CO3��O2����Ӧ���������������Ϊ224mL����״�����������ɵ���������0.01mol���������Ƶ����ʵ���Ϊ0.02mol��
�������ƵĴ���=![]() ��100%=78%��
��100%=78%��
�ʴ�Ϊ��78%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йس�������Ʒ��ʹ���У�����Ϊ�������ǣ�������
A.ʢ��ʳ��
B.����ˮ
C.�ý���˿��ϴ������۹�
D.�ü�ˮϴ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����Ũ�Ⱦ�Ϊ0.1mol��L-1������ֱ�ΪVa��Vb��HA��Һ��BOH��Һ����ͬ����Ȼ�ϣ��ұ���Va+Vb=100mL��Va��Vb����Һ��pH�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
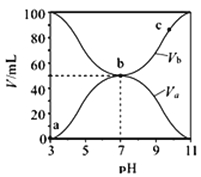
A. Ka(HA)��1��10-6
B. c��ʱ�� 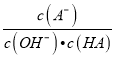 ���¶����߶�����
���¶����߶�����
C. a��c������ˮ�ĵ���̶�ʼ������
D. b��ʱ��c(B+)=c(A-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ������ȡ�����������Cl2�������м���Cl2����ʵ���װ�á�����Eƿ�з��и����ɫ������F��Ϊͭ����F�Ҷ˳����ܿڸ���������֬�ޡ�
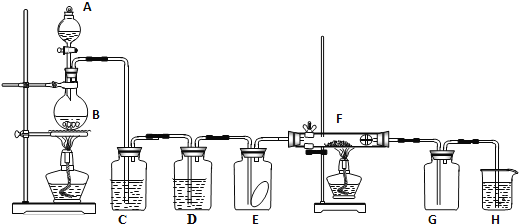
��1��д���Ʊ������ķ�Ӧ����ʽ����˫���ű�������ת�ƹ���___________��
��2��C���Լ���_______��D���Լ���������_________��
��3��E��������_____________��F��������________��H�з�����Ӧ�Ļ�ѧ����ʽΪ___________________��
��4��KMnO4��Ũ���ᷴӦҲ�ܲ�������������ƽ���·���ʽ��
____KMnO4 + ____HCl��____KCl + ____MnCl2 + ____Cl2�� + ____H2O��
����Ӧ����0.1 mol Cl2����ת�Ƶĵ�����ĿΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Fe2+�pNO3-�pNH4+�pFe3+��H+- H2O������,�ֱ�����һ��������ԭ��Ӧ�еķ�Ӧ���������,���������������( )
A. ����1mol NO3-�μӻ�ԭ��Ӧ,��ת��8mole- B. ��ԭ����ΪNH4+
C. �������뻹ԭ�������ʵ���֮��Ϊ8:1 D. �÷�Ӧ��Fe2+������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ���������仯�����Ȼ�����ǻ�ѧ��Ӧ�������仯����Ҫ��ʽ֮һ��
��1����ӦA(g)��B(g)��C(g)��D(g)����Ӧ�����������仯����ͼ��ʾ���ش��������⣺

�ٻ�ѧ��Ӧ�в��������仯�ı���ԭ����______________��
�ڸ÷�Ӧ��_____��Ӧ������Ȼ���ȡ�������H��__________ (��E1��E2��ʾ)��
�ۼ�������Ը÷�Ӧ�Ħ�H�Ƿ���Ӱ�죿___________��
��2����֪��һ�������£���1molH��H����1molCl��Cl����1molH��Cl����Ҫ�������ֱ���436kJ��243kJ��432kJ����ӦH2(g)��Cl2(g)��2HCl(g) �Ħ�H��_____��
��3����֪��2CH3OH(l)��2O2(g)��2CO(g)��4H2O(g) ��H1����a kJmol��1
2CO(g)��O2(g)��2CO2(g) ��H2����b kJmol��1
H2O(g)��H2O(l) ��H3����c kJmol��1
���ʾCH3OH(l)ȼ���ȵ��Ȼ�ѧ����ʽΪ_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵʱ���ܹ۲쵽�����ЧӦ���ǣ� ��
A.NaCl��ҺB.������Һ
C.CuSO4��ҺD.�������ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ڵ���ʵ���(���� )
A. NaOH��Һ B. K2SO4 C. CO2 D. Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2�㷺����ҽҩ�����Ṥҵ�������շ����е�SO2�������·�����
������ | �ü�ʽ������Al2(SO4)x(OH)y��Һ���ո���SO2 |
������ | ��Fe2+��Fe3+���£��ÿ���(O2)��SO2����ΪH2SO4 |
��1��������Ĺ������¡�
�� �Ʊ�Al2(SO4)x(OH)y
��Al2(SO4)3��Һ�м���CaO��ĩ����pH��3.6�� CaO������֮һ�Ǵٽ�_______ˮ�⣨�����ӷ��ţ���ͬ�������dz���һ����_______��
�� ���գ�Al2(SO4)x(OH)y����SO2��IJ�����_______��д��ѧʽ����
�� ���������Ȣ��в������SO2��Al2(SO4)x(OH)y������
��2���������У���Fe2+���£�SO2��O2��H2O����H2SO4�Ļ�ѧ����ʽ��______��
��3���������У�Fe2+�Ĵ����̿ɱ�ʾ���£�
����2 Fe2++ SO2+ O2=2 Fe3++ SO42-
���� ����
�� д���������ӷ���ʽ��______��
�� ����ʵ�鷽����֤ʵ���������̡���ʵ�鷽������������
a����FeCl2��Һ����KSCN���ޱ仯
b����FeCl2��Һͨ������SO2������KSCN����ɫ��졣
c��ȡb����Һ��_______��
��4���������У����������õζ����ⶨ�����в���SO2�ĺ�������V L���ѻ���Ϊ��״���������е�SO2��1%��H2O2��ȫ���գ�����Һ����ͼ��ʾװ�õζ���������a mL c mol/L NaOH��Һ��

�� H2O2����SO2�Ļ�ѧ����ʽ_______��
�� �����в���SO2���������Ϊ_______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com