
����Ŀ������A��B��C��D��E��F���ֶ�����Ԫ�أ����ǵ�ԭ��������������A��Dͬ���壮C��Eͬ���壬D��E��Fͬ���ڣ�A��B������������֮����C��������������ȣ�A�ֱܷ���B��C�γɵ���������ȵķ��ӣ���A��C�γɵĻ����ﳣ����ΪҺ̬��A�ֱܷ���E��F�γɵ���������ȵ�������ӣ�
��ش��������⣨���е���ĸֻ����Ԫ�ش��ţ���ʵ��Ԫ�ط����أ���
��1��A��F����Ԫ�أ�����������ˮ�����Լ��Ե�Ԫ�������ڱ��е�λ������
��2��A��C��D����Ԫ����ɵ�һ�ֳ�������������Ҫ�Ĺ�ҵ��Ʒ���û����ﺬ�еĻ�ѧ��Ϊ��
��3��B��F����Ԫ���γɵ�һ�ֻ�������ӣ���ԭ�Ӿ���8e���ȶ��ṹ���õ���ʽ��ʾ�û�������γɹ�����
��4��E������������ˮ�������ΪǦ���صĵ������Һ��д���õ�طŵ�ʱ����������ʽ������ ��
��5���Ƚ�E��F�ķǽ�����ǿ����EF������ڻ�С�ڣ���д��������֤�ý��۵�һ����ѧ����ʽ�� ��
���𰸡�
��1���������ڵ�IA��
��2�����Ӽ������ۼ�
��3��![]()
��4��PbO2+2e��+4H++SO42��=PbSO4+2H2O
��5��С�ڣ�Cl2+H2S=S+2HCl��Cl2+Na2S=S+2NaCl
���������⣺A��B��C��D��E��F���ֶ�����Ԫ�أ����ǵ�ԭ��������������C��Eͬ���壬��֪C���ڵڶ����ڡ�E���ڵ������ڣ���D��E��F���ڵ������ڣ�A��Dͬ���壬����������С��C�ģ�A��C�γɵ����ֻ������ڳ����¾�ΪҺ̬����AΪHԪ�أ�CΪOԪ�أ�EΪSԪ�أ�DΪNa��A��B������������֮����C��������������ȣ���B������������Ϊ5�����ԭ����������֪BΪNԪ�أ�HԪ������NԪ�ء�OԪ���γɵ�������ȵķ��ӣ�A�ֱܷ���E��F�γɵ���������ȵ�������ӣ�����Ӻ��е�����Ϊ18��F��ԭ�����������FΪClԪ�أ�
��1.��A��F����Ԫ�أ�����������ˮ�����Լ�����Na�������ڱ��е�λ���ǣ��������ڵ�IA�壬���Դ��ǣ��������ڵ�IA�壻
��2.��A��C��D����Ԫ����ɵ�һ�ֳ���������ΪNaOH���������Ӽ������ۼ������Դ��ǣ����Ӽ������ۼ���
��3.��B��F����Ԫ���γɵ�һ�ֻ�������ӣ���ԭ�Ӿ���8e���ȶ��ṹ���÷���ΪNCl3 �� �õ���ʽ��ʾ�û�������γɹ��� 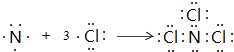 ��
��
���Դ��ǣ� 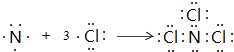 ��
��
��4.��E������������ˮ����Ϊ���ᣬ����ΪǦ���صĵ������Һ������������ԭ��Ӧ���õ�طŵ�ʱ����������ʽ��PbO2+2e��+4H++SO42��=PbSO4+2H2O�����Դ��ǣ�PbO2+2e��+4H++SO42��=PbSO4+2H2O��
��5.��ͬ����������ҷǽ����Լ������ʷǽ�����SС��Cl�ģ�������֤�ý��۵�һ����ѧ����ʽ��Cl2+H2S=S+2HCl��Cl2+Na2S=S+2NaCl�����Դ��ǣ�С�ڣ�Cl2+H2S=S+2HCl��Cl2+Na2S=S+2NaCl��


 ȫ�ų��100��ϵ�д�
ȫ�ų��100��ϵ�д� Ӣ�ŵ��ϵ�д�
Ӣ�ŵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ˮ��Һ��˵����ȷ���ǣ� ��
A.HNO3��Һ����OH��
B.�����£��κ����ʵ�ˮ��Һ�ж���H+��OH�� �� ��KW=10��14
C.NaCl��Һ�м���OH��Ҳ��H+
D.����������Һ����H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ȼ�ѧ����ʽ����CO��g��+ ![]() O2 ��g��=CO2 ��g����H=��283.0kJmol��1
O2 ��g��=CO2 ��g����H=��283.0kJmol��1
��H2��g��+ ![]() O2 ��g��=H2O��g������H=��241.8kJmol��1������˵����ȷ���ǣ� ��
O2 ��g��=H2O��g������H=��241.8kJmol��1������˵����ȷ���ǣ� ��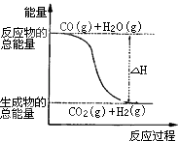
A.H2��ȼ����Ϊ241.8kJ?mol��1
B.�ɷ�Ӧ�١��ڿ�֪��ͼ��ʾ���Ȼ�ѧ����ʽΪCO��g��+H2O��g��=CO2��g��+H2��g����H=��41.2 kJ?mol��1
C.H2��g��ת���H2O��g���Ļ�ѧ��Ӧһ��Ҫ�ͷ�����
D.���ݢ���֪��ӦH2��g��+ ![]() O2 ��g��=H2O��l������H����241.8 kJ?mol��1
O2 ��g��=H2O��l������H����241.8 kJ?mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2CO��g��+O2��g���T2CO2��g����H=��566kJmol��1
N2��g��+O2��g���T2NO��g����H=+180kJmol��1
��2CO��g��+2NO��g���TN2��g��+2CO2��g���ġ�H�ǣ� ��
A.��386 kJmol��1
B.+386 kJmol��1
C.��746 kJmol��1
D.+746 kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(AgBrO3)�ܽ�����¶ȱ仯������ͼ��ʾ������˵���������( )
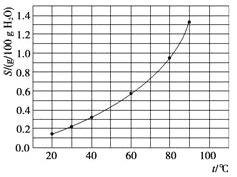
A. ���������ܽ�ʱ���ȹ���
B. �¶�����ʱ�������ܽ��ٶȼӿ�
C. 60 ��ʱ��������KspԼ����6��10��4
D. ��������к��������������������ؽᾧ�����ᴿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����:���������й�ͼ�ش��й����⣺
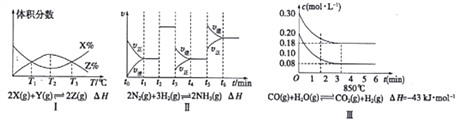
(1)��ͼI֪���÷�Ӧ����H__________0������>������<������
(2)��ͼ��֪����Ӧ��________ʱ����NH3���������(��t1��t2��t2��t3��t3��t4��t4��t5��t5��t6)
(3)ͼ����ʾ��10L������850��ʱ�ķ�Ӧ����ͼ֪����4minʱ����Ӧ�ų�������Ϊ___________��
��: 25��ʱ�������ΪVa��pH=����ijһԪǿ�������ΪVb��pH=b��ijһԪǿ���ϣ��Ҽ�֪��=0.56��
Va��������и��⡣
(1)���Ƿ���Ե���3 (����������������)____________��
(2)��a+b=13,�������ᣬ����KOH����������ζ�50.00mLKOH��Һ�����ζ�����Һ��pH=2ʱ,��������11.11mL����b=___________��
(3)����֪����ǿ�ᣬ����ǿ���ͼ�ǡ���к���������ȡֵ��Χ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A. ��ˮ��ͨ�����SO2��2NH3��H2O+SO2=2NH4++SO32-+H2O
B. FeI2��Һ��ͨ������Cl2��2Fe2++Cl2=2Fe3++2C1-
C. ��ʯī���缫���MgCl2��Һ��2Cl-+2H2O![]() Cl2��+H2��+2OH-
Cl2��+H2��+2OH-
D. ����۵⻯����Һ�м�ϡ����,�ڿ����з��ú���Һ������4H++4I-+O2=2I2+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ˮ��Һ�ܵ��磬�������ڵ���ʵĻ�������
A��SO3 B��Cl2
C��NH4NO3 D��HNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ�����
Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
A | ���������Ӳ㣬K��M�������֮�͵���L������� |
B | �������н�������ǿ |
C | �����µ���Ϊ˫ԭ�ӷ��ӣ��⻯���ˮ��Һ�ʼ��� |
D | Ԫ�����������+7�� |
��1���û�ѧ����ش��������⣺
��AԪ�������ڱ��е�λ����
��C���ʷ��ӵĵ���ʽ��
��D��ԭ�ӽṹʾ��ͼ��
�ܵ���ʽ��ʾA��BԪ����ɵĻ�������γɹ��̣� ��
��2��Ԫ��D��Ԫ��A��ȣ��ǽ����Խ�ǿ��������Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ��������ѡ����ţ���
a��������D�ĵ��ʺ�A�ĵ���״̬��ͬ
b��D���⻯���A���⻯���ȶ�
c��һ��������D��A�ĵ��ʶ������Ʒ�Ӧ
d��A��ۺ��������������D��ۺ�����
e��D��������A���⻯�ﷴӦ����A����
��3��X����A��B��C��D����Ԫ���е�ij��Ԫ����ɵĵ��ʣ��ܾ�ͼ��ʾ�Ĺ���ת��Ϊ������������ȥ���� ![]()
����Y���д̼�����ζ����ɫ���壬��Yͨ��BaCl2��Һ�У�������Ȼ��μ�����H2O2��Һ���а�ɫ�������ɣ���ð�ɫ����Ϊ �� ��д��Y��H2O2��Һ��Ӧ�Ļ�ѧ����ʽ����
����Z�Ǻ���ɫ���壬��Z��W�ķ�Ӧ���������뻹ԭ�����ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com