
【题目】将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaoH溶液的体积关系如下图所示。 若不考虑金属和盐酸反应时HCI的挥发,则下列说法不正确的是( )
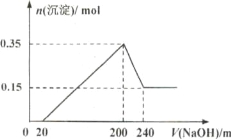
A.镁和铝的总质量为9 g
B.盐酸的物质的量浓度为10 mol/L
C.NaOH溶液的物质的量浓度为5 mol/L
D .生成的氢气在标准状况下的体积为11.2 L
【答案】D
【解析】
试题分析:根据反应的先后顺序H++OH-=H2O,Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,Al(OH)3+OH-=AlO2-+2H2O,氢氧化镁物质的量为0.15mol,则氢氧化铝的物质的量为(0.35-0.15)mol=0.2mol,A、根据元素守恒,合金的质量为(0.15×24+0.2×27)g=9g,故说法正确;B、200-240mL之间发生反应是Al(OH)3+OH-=AlO2-+2H2O,则c(NaOH)=0.2/(240-200)×10-3mol/l=5mol·L-1,加入200mL的NaOH,沉淀达到最大,溶质为NaCl,根据元素守恒,n(NaCl)=n(NaOH)=n(HCl)=200×10-3×5mol=1mol,c(HCl)=1/100×10-3mol·L-1=10mol·L-1,故说法正确;C、根据上述分析,故说法正确;D、 根据得失电子数目守恒,即0.15×2+0.2×3=V(H2)×2/22.4,解得V(HCl)=10.08L,故说法错误。


科目:高中化学 来源: 题型:
【题目】TiO2在工业生产和日常生活中有重要用途。
工业上用钛铁矿(主要成分是TiO2、少量FeO和Fe2O3)制备TiO2,再用TiO2制备TiCl4等产品的一种工艺流程如图所示:
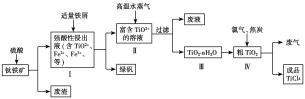
已知:TiO2+发生水解反应的化学方程式为TiO2++(n+1)H2O![]() TiO2·nH2O+2H+。
TiO2·nH2O+2H+。
(1)硫酸与TiO2反应的离子方程式是_________________________。
(2)由TiO2制取TiCl4时涉及的反应有:
TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH1=-72 kJ·mol-1;
TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g)
ΔH2=+38.8 kJ·mol-1;
C(s)+CO2(g)===2CO(g)
ΔH3=+282.8 kJ·mol-1。
①反应C(s)+CO2(g)===2CO(g)在高温下能够自发进行的原因是____________________。
②反应C(s)+O2(g)===CO2(g)的ΔH=________。
(3)向Ⅰ中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:2Fe3++Fe===3Fe2+;2TiO2+(无色)+Fe+4H+===2Ti3+(紫色)+Fe2++2H2O;Ti3+(紫色)+Fe3++H2O===TiO2+(无色)+Fe2++2H+。
①结合信息判断Fe3+、TiO2+、Fe2+的氧化性强弱关系:________>________>________。
②加入铁屑的作用是_____________________。
(4)向Ⅱ中不断通入高温水蒸气,维持溶液沸腾一段时间,析出水合二氧化钛沉淀。请用化学平衡理论分析通入高温水蒸气的作用:_________________________。
(5)依据绿色化学理念,该工艺流程中存在的不足之处是_________________________(写出一条即可)。
(6)工业上可通过电解TiO2来获得Ti(同时产生O2):处理过的TiO2为阴极,石墨为阳极,熔融CaCl2为电解液,电解槽中加入炭块。阴极反应式为_____________________;
电解过程中需定期向电解槽中加入炭块的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质的固体的是( )
A. AlCl3 B. MgSO4 C. (NH4)2CO3 D. NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
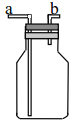
(1)排空气法收集气体,若收集 CO2气体,进气口为____________(填“a”或“b”)
(2)若瓶中装满水,可用于收集下列气体中的_____________(选填编号)
①NO ②NO2③NH3④HCl
(3)如果广口瓶中盛放浓硫酸,可以用作气体干燥装置,则该装置不可以干燥的气体有_________(选填编号)
①HCl ②H2③NH3④CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
A. W2-、X+ B. X+、Y3+
C. Y3+、Z2- D. X+、Z2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(6分)A、B、C、D、E五种物质中均含有同一种元素,其相互转化关系如下图所示:
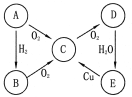
请回答下列问题:
(1)如果A是淡黄色固体,则B是(写化学式,下同) ,E是 。
(2)如果A是无色气体:B→C的化学方程式为 ;E→C的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是( ) ①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A.①和②
B.①和③
C.③和④
D.①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温、常压下,饱和CO2溶液的pH为3.9,用标准浓度的盐酸来滴定锥形瓶中放置时间较长的氢氧化钠溶液,应选用的指示剂及滴定终点颜色变化的情况最好是( )
A.石蕊,由蓝变红 B.酚酞,红色褪去
C.甲基橙,由黄变橙 D.甲基橙,由橙变黄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如图所示,图中的ΔH表示生成1 mol产物的数据。可知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应。下列说法正确的是( )
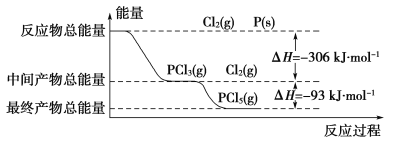
A.其他条件不变,升高温度有利于PCl5的生成
B.反应2P(s)+5Cl2(g)==2PCl5(g)对应的反应热 ΔH=-798 kJ·mol-1
C.P和Cl2反应生成PCl3的热化学方程式为:2P(s)+3Cl2(g)==2PCl3(g) ΔH=-306 kJ·mol-1
D.其他条件不变,对于2PCl5(g)==2P(s)+5Cl2(g) ΔH反应,增大压强,PCl5的转化率减小,ΔH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com