
【题目】按要求对下图中两极进行必要的联接并填空:

(1)在A图中,使铜片上冒H2气泡。请加以必要联接__________(在答题卡的图中画线),则联接后的装置叫_________。电极反应式:锌板:____________________;铜板:___________。
(2)在B图中(a、b均为惰性电极),使a极析出铜,则b析出____________。加以必要的联接后,该装置叫___________。电极反应式:a极:___________________________b极:____________________________。经过一段时间后,停止反应并搅均溶液,溶液的pH值________________(升高、降低、不变),加入一定量的____________后,溶液能恢复至与电解前完全一致。
(3)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+![]() O2(g) ==== CH3OH(g) △H=-128.5kJ/mol
O2(g) ==== CH3OH(g) △H=-128.5kJ/mol
副反应有:CH4(g)+![]() O2(g) ==== CO(g)+2H2O(g) △H=a kJ/mol
O2(g) ==== CO(g)+2H2O(g) △H=a kJ/mol
CH4(g)+2O2(g) ==== CO2(g)+2H2O(g) △H=b kJ/mol
CH4(g)+O2(g) ==== HCHO(g) +H2O(g) △H=c kJ/mol
甲醇与氧气反应生成HCHO(g)和水蒸汽的热化学方程式为_____________________。
【答案】  原电池 Zn-2e- =Zn2+ 2H+ +2e-=H2↑ O2 电解池 Cu2++2e- =Cu 4OH――4e-=O2↑+2H2O 降低 CuO或者CuCO3 CH3OH(g)+1/2O2(g)→HCHO(g)+H2O(g) △H =(c +128.5)kJ·mol-1
原电池 Zn-2e- =Zn2+ 2H+ +2e-=H2↑ O2 电解池 Cu2++2e- =Cu 4OH――4e-=O2↑+2H2O 降低 CuO或者CuCO3 CH3OH(g)+1/2O2(g)→HCHO(g)+H2O(g) △H =(c +128.5)kJ·mol-1
【解析】(1)A图中,Cu与硫酸不反应,无氢气产生,现在要使铜上产生H2气体,必须形成原电池,让铜作正极,溶液中的H+在铜上得到电子,生成H2。连接的装置如右图:  ;此装置叫做原电池;锌做负极失去电子,电极方程式为:Zn-2e- =Zn2+;铜作正极,溶液中的氢离子得到电子生成H2,电极方程式为:2H++2e-=H2↑。
;此装置叫做原电池;锌做负极失去电子,电极方程式为:Zn-2e- =Zn2+;铜作正极,溶液中的氢离子得到电子生成H2,电极方程式为:2H++2e-=H2↑。
(2)B图中,a、b均为惰性电极,不参与反应,则此装置必为电解池,a极析出铜,则a极为阴极,电极方程式为:Cu2++2e- =Cu ;b极为阳极,溶液中的OH-失去电子生成O2,发生的电极反应式为:4OH――4e-=O2↑+2H2O。由于OH-失去电子生成O2,OH-浓度减小,导致H+浓度增大,溶液的酸性增强,pH值降低。由上分析可知:阳极析出O2,阴极析出Cu,溶液中生成HNO3 ,若要使溶液恢复至与电解前完全一致,则可以加入CuO或CuCO3 与生成的HNO3 反应,使生成的HNO3消耗掉,同时生成电解时消耗的Cu2+和H2O 。故答案依次为: O2 、电解池、Cu2++2e- =Cu、 4OH――4e-=O2↑+2H2O、 降低、 CuO或者CuCO3
(3)根据盖斯定律,几个热化学方程式相加减可得到要求的新的热化学方程式。先写出要求的化学方程式,再将新的化学方程式与已知的化学方程式对比做出判断。要求的化学方程式为:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g),与上面的方程式对比发现,只要将已知的第四个热化学方程式减去第一个热化学方程式即可得到要求的化学方程式,同时反应热也相减,故要求的热化学方程式的反应热为c kJ/mol-(-128.5kJ/mol)=(c +128.5)kJ·mol-1。答案为:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g) △H =(c +128.5)kJ·mol-1


科目:高中化学 来源: 题型:
【题目】无机物甲、乙、丙经一步反应的转化关系如图所示,其中部分反应物、生成物及反应条件已略去. 
(1)若反应皆为化合反应,且均在点燃条件下发生,则丙的化学式 为;
(2)若反应皆为置换反应,且均在溶液中举行,甲、乙、丙都为金属,则它们的金属活动性由强到弱的顺序是(用“甲”、“乙”、“丙”表示);
(3)若反应皆为复分解反应,乙为白色难溶物. ①若甲为常见的酸,甲、乙、丙含相同的原子团,丙溶液为蓝色,则丙生成乙的化学方程式为(写一个);
②若甲为常见的碱,且相对分子质量为74,甲、乙、丙含相同的金属元素,丙溶液为无色,则丙生成乙的化学方程式为(写一个)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500多年前,一艘载着天然苏打晶体的商船在航行中搁浅,船员们便在附近的沙滩上用几块苏打晶体支锅煮饭。之后他们惊奇地发现,锅下苏打在沙粒接触处出现了许多晶莹发亮的珠子。回答下列问题
(1)请你分析一下,这种珠子可能是_____________
A.水晶颗粒 B.无水碳酸钠 C.玻璃珠 D.晶体硅
(2)实验室可在坩埚中模拟制备此物质,下列坩埚中可选用的是_______(填字母)。
A.普通坩埚 B.石英坩埚 C.刚玉坩埚 D.铁坩埚
(3)制备此物质的主要反应方程式为_________(任写一个)。
(4)氢氟酸常用作此物质的蚀刻剂,原因为:_________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42﹣、CO32﹣ .
(1)为了进一步确认,对该溶液进行实验检测: 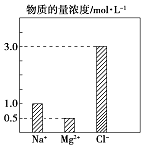
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 仔细观察坐标图 | 肯定无 | 肯定无该离子的理由 |
步骤二 | 该溶液呈无色、透明、均一状态 | 肯定无 | 肯定无该离子的理由 |
步骤三 | 加入足量BaCl2溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失 | 肯定有SO42﹣、H+;肯定无Ba2+ | 肯定有H+的理由 |
(2)实验操作的步骤三中称量沉淀前的实验操作步骤有:过滤、、灼烧、在干燥器中冷却.
(3)原溶液中H+物质的量浓度为mol/L.
(4)向溶液中加入NaHCO3溶液,反应的离子方程式为: .
(5)若向 100mL 该溶液中加入 1mol/L 的 Ba(OH)2溶液,恰好沉淀完全时加入的Ba(OH)2溶液体积为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列事实,能确定某晶体一定是离子晶体的是( )
A.晶体熔点达2500℃B.固态时不导电,溶于水能导电
C.固态时不导电,熔融状态下能导电D.温度越高,溶解度越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。某工厂处理氨氮废水的流程如下:

回答下列问题:
(1)过程I加NaOH溶液的作用是___________________________(用离子方程式表示);鼓入大量空气的目的是____________________________。
(2)已知:水体中以+l价或单质形式存在的氯元素,称为“余氯”。过程Ⅱ中加入适量液氯,控制pH在6-7,将氨氮转化为N2。实验测定氯铵比与余氯、残余NH4+的浓度关系如下图所示。

①为了完全从废水中去除氨氮,根据图像分析,投入的Cl2与NH4+的最佳比值为_________。
②过程Ⅱ分步发生3个反应:
i.Cl2+H2O =H++Cl- +HClO
ii.NH4++HClO==NH2Cl+H++H2O(NH2Cl中Cl元素为+l价)
iii.HClO继续参与反应,其离子方程式为________________________________。
③图中a点余氯浓度较大的原因是________________________________________。
(3)若含余氯废水中折合Cl2的含量是71 mg·L-1,则处理10m3含余氯废水,至少添加Na2SO3_____kg(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产和生活中使用非常广泛.
I、NaNO2外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:
2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.
(1)上述反应中用单线桥标出电子转移的方向和数目.
(2)某厂废液中,含有2%~5%的NaNO2 , 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是 .
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(3)II.过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.根据下列反应回答问题:
A.Na2O2+2HCl═2NaCl+H2O2
B.Ag2O+H2O2═2Ag+O2↑+H2O
C.2H2O2═2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O
上述反应中,H2O2仅体现氧化性的反应是(填序号)
(4)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是
(5)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、MnO4﹣、H2O、Mn2+、H2O2、H+ . 已知该反应中H2O2只发生了如下过程:H2O2→O2 .
①将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中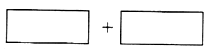
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子为 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下对组成细胞和生物体的有机物的描述中,正确的是
A. 多肽链在核糖体上一旦合成便具有生物活性
B. 质量相同的糖、脂肪、蛋白质氧化分解所释放的能量是相同的
C. 细胞核内的核酸只含脱氧核糖,细胞质中的核酸只含核糖
D. 全部的抗体、绝大多数的酶、部分激素的化学本质是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活密切相关。下列做法值得提倡的是( )
A.小苏打用作净水剂B.饮高度酒预防新冠肺炎
C.漂粉精作食品漂白剂D.“地沟油”加工为生物燃料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com