
【题目】有关下列图像的分析错误的是
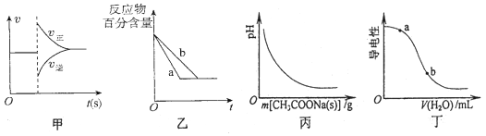
A.图甲可表示对平衡N2(g)+3H2(g)![]() 2NH3(g)加压、同时移除部分NH3时的速率变化
2NH3(g)加压、同时移除部分NH3时的速率变化
B.图乙中a、b曲线可表示反应H2(g)十I2(g)![]() 2HI(g)在有催化剂和无催化剂存在下建立平衡的过程
2HI(g)在有催化剂和无催化剂存在下建立平衡的过程
C.图丙表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化
D.图丁表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a<b
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图所示)可用于ⅢB族元素对应的离子萃取,如La2+、Sc2+。写出基态二价钪离子(Sc2+)核外电子排布式:__________。其中电子占据的轨道数为__________个。
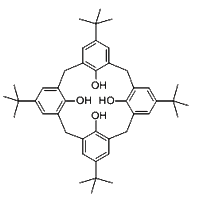
(2)对叔丁基杯[4]芳烃由4个烃基构成杯底,其中条件氧原子的杂化方式为___________。烃基间的相互作用力为_______________。
(3)不同大小的杯芳烃能识别某些离子,如:N3-、SCN-等。根据等电子体原料判断N3-空间构型为______;一定条件下,SCN-与MnO2反应可得到(SCN)2。试写出(SCN)2 的结构式:_______________。
(4)已知C60分子结构和C60晶胞示意图(如图Ⅱ,图Ⅲ所示):
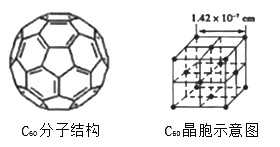
则一个C60分子中含有σ键个数为__________,与每个C60分子距离最近且相等的C60分子有_________个,C60晶体的密度为__________(计算结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80 ℃时,2 L 密闭容器中充入0.40 mol N2O4,发生反应N2O4![]() 2NO2 △H=+Q kJ·mol-1(Q>0),获得如下数据:下列判断正确的是
2NO2 △H=+Q kJ·mol-1(Q>0),获得如下数据:下列判断正确的是
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol·L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
A. 升高温度该反应的平衡常数K减小
B. 20~40 s 内,v(N2O4)=0.002 mol/L .s
C. 反应达平衡时,吸收的热量为0.30 Q kJ/mol
D. 100s 时再通入0.40 mol N2O4,达新平衡时N2O4的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为 。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将 (填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol·L-1,Q1、Q2、Q3 之间满足何种关系:Q3= 。
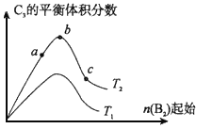
(4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容容器,起始时加入4 molA2和2 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4(填“>”、“<”或“=”)。
(6)下列措施可以同时提高反应速率和B2的转化率是 (填选项序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的C3 d.升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com