
����Ŀ��5���ȩ�2��3�����⩁1����ͪ��һ����Ҫ��ҽҩ�м��壮��֪��R��Cl ![]() RCH��COOC2H5��2
RCH��COOC2H5��2![]() RCH2COOH
RCH2COOH
�Ի�����A������ʽΪC7H7Cl��Ϊԭ�Ϻϳ�5���ȩ�2��3�����⩁1����ͪ��������F�������������£�
A ![]() B
B ![]()

![]() D
D ![]()

![]()

��1��д��A�ṹ��ʽ �� ��ӦE��F�ķ�Ӧ���� ��
��2��������B�м�����������������ˮ��Һ���ڸ��¸�ѹ���������Ӻ��ʵĴ���������±��ԭ�Ӳ���ˮ�⣩��Ӧ�ķ���ʽ ��
��3��ij��������D��ͬ���칹�壬��ʹFeCl3��Һ����ɫ���ҷ�����ֻ��3�ֲ�ͬ��ѧ�������⣮д���û�����Ľṹ��ʽ������дһ�֣���
��4��E��F��ת���У������һ����F��Ϊͬ���칹��ĸ������ṹ��ʽΪ ��
��5����������֪ʶ����������Ϣ��д���Ի�����F��CH2��COOC2H5��2Ϊ�л���Ӧԭ���Ʊ� ![]() �ĺϳ�·������ͼ��ע����Ӧ���������ϳ�·������ͼʾ�����£� CH3CH2OH
�ĺϳ�·������ͼ��ע����Ӧ���������ϳ�·������ͼʾ�����£� CH3CH2OH ![]() CH2=CH2
CH2=CH2 ![]()
![]()
���𰸡�
��1�� ��ȡ����Ӧ
��ȡ����Ӧ
��2�� +3NaOH
+3NaOH ![]() ?
? 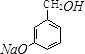 +2NaCl+H2O
+2NaCl+H2O
��3��
��4��
��5��
���������⣺��C�Ľṹ��ʽ�����Ϣ�е�һ�������ƿ�֪BΪ  ��
��  �е���ԭ�ӱ�ȡ��������ȡ����Ӧ����C��A�������ڹ��������·�������ȡ����Ӧ����B�����A�ķ���ʽ��֪��ṹ��ʽΪ
�е���ԭ�ӱ�ȡ��������ȡ����Ӧ����C��A�������ڹ��������·�������ȡ����Ӧ����B�����A�ķ���ʽ��֪��ṹ��ʽΪ  ��C������Ϣ�еڶ�����Ӧ�õ�DΪ
��C������Ϣ�еڶ�����Ӧ�õ�DΪ 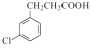 ��D�����Ȼ��Щ�OH����Clȡ������E��E��ȥ1����HCl�õ�F����1��A�ķ���ʽ��֪��ṹ��ʽΪ��
��D�����Ȼ��Щ�OH����Clȡ������E��E��ȥ1����HCl�õ�F����1��A�ķ���ʽ��֪��ṹ��ʽΪ��  ����EF�ṹ��ʽ��֪��E��F��ȡ����Ӧ�� ���Դ��ǣ�
����EF�ṹ��ʽ��֪��E��F��ȡ����Ӧ�� ���Դ��ǣ�  ��ȡ����Ӧ����2��BΪ
��ȡ����Ӧ����2��BΪ 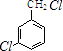 ����NaOH��ˮ��Һ�з���Clԭ�ӵ�ˮ�⣬���ɷ��ǻ��ʹ��ǻ������ǻ��ܹ���NaOH��Ӧ����Ӧ�Ļ�ѧ����ʽΪ��
����NaOH��ˮ��Һ�з���Clԭ�ӵ�ˮ�⣬���ɷ��ǻ��ʹ��ǻ������ǻ��ܹ���NaOH��Ӧ����Ӧ�Ļ�ѧ����ʽΪ��  +3NaOH
+3NaOH ![]()
 +2NaCl+H2O��
+2NaCl+H2O��
���Դ��ǣ�  +3NaOH
+3NaOH ![]()
 +2NaCl+H2O����3��ij��������D��ͬ���칹�壬��ʹFeCl3��Һ����ɫ��˵���з��ǻ����ҷ�����ֻ��3�ֲ�ͬ��ѧ�������⣬�������������Ļ�����Ľṹ��ʽΪ
+2NaCl+H2O����3��ij��������D��ͬ���칹�壬��ʹFeCl3��Һ����ɫ��˵���з��ǻ����ҷ�����ֻ��3�ֲ�ͬ��ѧ�������⣬�������������Ļ�����Ľṹ��ʽΪ  ��
�� 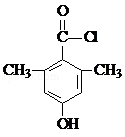 ��
��
���Դ��ǣ�  ��
�� 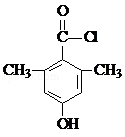 ����4��E��F��ת���У������һ����F��Ϊͬ���칹��ĸ������ṹ��ʽΪ��
����4��E��F��ת���У������һ����F��Ϊͬ���칹��ĸ������ṹ��ʽΪ��  ��
��
���Դ��ǣ�  ����5���Ի�����F��CH2��COOC2H5��2Ϊ�л���Ӧԭ���Ʊ�
����5���Ի�����F��CH2��COOC2H5��2Ϊ�л���Ӧԭ���Ʊ� ![]() ��Ҫ�Ƚ�F�е��ʻ���������ͬʱ����Ԫ�����м�����±ԭ�ӣ����������Ϣ�ĵ�һ���õ���Ʒ��Ϊ�˿����Ƚ�F�������ӳɡ����پ�����ȥ�����Ȼ���ӳɣ�����CH2��COOC2H5��2��Ӧ��õIJ���������ˮ��ò�Ʒ���ϳ�·������ͼΪ��
��Ҫ�Ƚ�F�е��ʻ���������ͬʱ����Ԫ�����м�����±ԭ�ӣ����������Ϣ�ĵ�һ���õ���Ʒ��Ϊ�˿����Ƚ�F�������ӳɡ����پ�����ȥ�����Ȼ���ӳɣ�����CH2��COOC2H5��2��Ӧ��õIJ���������ˮ��ò�Ʒ���ϳ�·������ͼΪ��  ��
��
���Դ��ǣ�  ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��WΪԭ��������������Ķ�����Ԫ�أ�Y��Z�ֱ��ǿ����͵ؿ��к�����ߵ�Ԫ�أ�W�ĵ��ʿ���������ˮ������X��Y��Z��W�Ȳ�ͬ����Ҳ��ͬ���塣
��1��д����X��Y��W����Ԫ����ɵĻ�������YX3�Ļ�ѧ����ʽ��___________________��
��2���õ���ʽ��ʾX2Z���γɹ��̣�_________________________��
��3��ij����С��������CuO��YX3��Ӧ���о�YX3��ij�����ʣ����������ʵ��װ��(�г�װ��δ����)����ʵ�顣��ش��������⣺

������b�п�ѡ����Լ�Ϊ________��
��ʵ���й۲쵽װ��C�к�ɫCuO��ĩ��Ϊ��ɫ���壬����������ɫ��ζ�����壬��������֤��YX3����________�ԣ�д����Ӧ�Ļ�ѧ����ʽ��____________��
��4����ҵ�ϳ���YX3����XYZ����Ԫ����ɵ�һ���ᣬ��100mL �����ϡH2SO4��ɵĻ����Һ�У�����������ʵ���Ũ��֮��Ϊ0.4mol/L�������Һ�м���������ͭ�ۺ���ȣ���ַ�Ӧ��������Һ��Cu2+�����ʵ���Ũ�����ֵΪ����Ӧǰ����Һ����仯���Բ��ƣ�____________mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�CO2�����öԴٽ���̼���Ĺ���������Ҫ���壮
��1����CO2�뽹̿��������CO��CO�����������ȣ���֪����Fe2O3��s��+3C��s��ʯī���T2Fe��s��+3CO��g����H1=+489.0kJmol��1
��C��s��ʯī��+CO2��g���T2CO��g����H2=+172.5kJmol��1
��CO��ԭFe2O3��s�����Ȼ�ѧ����ʽΪ ��
��2��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��CO2��g��+3H2��g��CH3OH��g��+H2O��g����H
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪK= ��
��ȡһ�����CO2��H2�Ļ�����壨���ʵ���֮��Ϊ1��3������������ܱ������У�����������Ӧ��Ӧ�����в�ü״�����������գ�CH3OH���뷴Ӧ�¶�T�Ĺ�ϵ��ͼ1��ʾ����÷�Ӧ�ġ�H�����������������=������ͬ��0��
�������ֲ�ͬ�����·�����Ӧ�����CH3OH�����ʵ�����ʱ��仯��ͼ2��ʾ������I�����Ӧ��ƽ�ⳣ����ϵΪK��K�� ��
��3����CO2Ϊԭ�ϻ����Ժϳɶ������ʣ��ٹ�ҵ������[CO��NH2��2]��CO2��NH3��һ�������ºϳɣ��䷴Ӧ����ʽΪ �� ��ʼ��̼�� ![]() =3���з�Ӧ����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ ��
=3���з�Ӧ����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ ��
����������Һ������ʽ��е�⣬CO2�ڵ缫�Ͽ�ת��Ϊ���飬�õ缫��Ӧ�ķ���ʽΪ ��
�۽�����CO2ͨ�뱥�Ͱ�ˮ�пɵõ���NH4HCO3 �� ��֪������һˮ�ϰ�Kb=1.8��10��5 �� ̼��һ�����볣��Ka=4.3��10��7 �� ��NH4HCO3��Һ��������ԡ��������ԡ����ԡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������Һ���ܴ���������ͨ����������Ӧ��������ܴ���������ǣ� ��
A.NH ![]() ��Ca2+��HSO
��Ca2+��HSO ![]() ��Cl�� ��������
��Cl�� ��������
B.Ba2+��NO ![]() ��Na+��Cl�� ����������
��Na+��Cl�� ����������
C.Na+��K+��HCO ![]() ��Cl�� ��������̼��
��Cl�� ��������̼��
D.Al3+��SO ![]() ��HCO
��HCO ![]() ��NO
��NO ![]() ?���Ȼ��⣩
?���Ȼ��⣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼ���漰��ƽ��ԭ����������أ� ��
A. ��ͼ��ʾ�����£���0.1mol?L��1��ˮ����HCl����ʱ����Һ������Ũ��������HCl�ı仯��ʵ�߱�ʾc��NH3?H2O�������߱�ʾc��NH
��ͼ��ʾ�����£���0.1mol?L��1��ˮ����HCl����ʱ����Һ������Ũ��������HCl�ı仯��ʵ�߱�ʾc��NH3?H2O�������߱�ʾc��NH ![]() ��������M��ʱ��Һ������
��������M��ʱ��Һ������
B. ��ͼ��ʾ2SO2��g��+O2��g��?2SO3��g����H��0�����淴Ӧ��ƽ�ⳣ�����¶ȵı仯
��ͼ��ʾ2SO2��g��+O2��g��?2SO3��g����H��0�����淴Ӧ��ƽ�ⳣ�����¶ȵı仯
C. ��ͼ��ʾ��Ӧ2NH3��g��?3H2��g��+N2��g�����ں��º�ѹװ���д�ƽ��ʱ��N2�����ʵ�����ͨ��NH3�����ʵ����ı仯��ϵ
��ͼ��ʾ��Ӧ2NH3��g��?3H2��g��+N2��g�����ں��º�ѹװ���д�ƽ��ʱ��N2�����ʵ�����ͨ��NH3�����ʵ����ı仯��ϵ
D. ��ͼ��ʾAgCl��s��?Ag+��aq��+Cl����aq�������ӵ�Ũ�ȹ�ϵ��������b��ʱ���������ֵ�ˮ���Ե���ƽ���ߵ�a�㴦
��ͼ��ʾAgCl��s��?Ag+��aq��+Cl����aq�������ӵ�Ũ�ȹ�ϵ��������b��ʱ���������ֵ�ˮ���Ե���ƽ���ߵ�a�㴦
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ��ж����ڵ�һ����,X��Y��Z��W����Ԫ�ص�ԭ�Ӻ�������������֮�͵���Y��ZԪ�ص�ԭ������֮��,��Z��W��ԭ������֮�͵����� ��
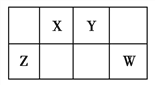
A. 27 B. 29 C. 31 D. 33
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�ೣ�������ʣ���������ͨ��һ����Ӧ��ֱ���γ��ε��� ��������
�ٽ������� ���ڼ�������� �ۼ�ܷǽ������� ���������������
A. �٢ڢ�B. �٢ܢ�C. �ڢݢ�D. ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̬��A��һ�ֻ������л�����ԭ�ϣ�Ŀǰʯ���ѽ��ѳ�Ϊ����A����Ҫ������A�ڱ�״���µ��ܶ�Ϊ1.25gL��1 �� D�ķ���ʽΪC4H8O2 �� D������������ˮ��õ�B��C��C����Է���������B��14�������л���֮���������ת����ϵ�� 
��ش��������⣺
��1��д��D�Ľṹ��ʽ�� ��
��2��д�����̢ٵĻ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��֪��1H216O��2H2S��3H218O��3H2S��S16O2����Щ�����к���____�ֺ��ء�����18O2-�����ӽṹʾ��ͼ��__________��
(2)���й����У����ۼ����ƻ�����________���ܱ�ʾ��Ӧ��������������������������Ļ�ѧ��Ӧ��___________��
�ٵ����� ��������������ȼ�� ��HCl ��������ˮ �ܾƾ�����ˮ
�ݱ��ڻ� �����������ۻ� ��NH4Cl���ȷֽ� ��(NH4)2SO4����ˮ
(3)����Ԫ�����ڱ���Ԫ�������ɷ���������ƶϣ����д������_______��
����(At)���⻯�ﲻ�ȶ� ����(Se)����������ȶ�
�����ԭ��ʧ����������þ�� �������������������Ƶļ���ǿ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com