
【题目】实验室有一包暗红色粉末样品可能是MgCO3、Fe2O3和FeO的混合物。经测定后,结论是不存在FeO。
I.某学生想自己设计实验方案,以证明样品中确实没有FeO。除样品外,实验室只提供以下试剂:KMnO4溶液、稀盐酸、稀硫酸、KSCN溶液、NaOH溶液,请你描述实验操作的步骤、实验现象和结论:__________________________________________________。
Ⅱ.测定混合物中Fe2O3的含量
实验室可用多种方法测定上述样品中Fe2O3的质量分数,某同学准备用如图所示各仪器 按一定顺序连接成一套完整的装置进行实验,以测定Fe2O3的质量分数。
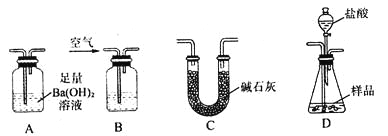
请回答下列问题:
(1)盛装盐酸的仪器的名称是___________,装置的连接顺序是___________→____________→____________→____________(填图中序号字母,各仪器只能选用一次)。
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物以实现充分反应外,还有一个重要作用是________________________________________________。
(3)为提高测定的准确度,在B中最应加入的物质是下列各项中的_____________(填序号)。
a.饱和NaHCO3溶液 b.蒸馏水
c.浓硫酸 d.NaOH溶液
(4)在进行实验方案评价时,有同学认为不必测定A中沉淀的质量,而只要测出装置A在吸收反应产生的气体前后的质量差,就能完成实验要求。实验证明,若用此法测得Fe2O3的质量分数将__________(填“偏大”“偏小”或“不变”之一)。
【答案】取少量样品于试管中,加入稀硫酸溶解,再加入少量KMnO4溶液,溶液不褪色,说明样品中没有FeO。 分液漏斗 B→D→A→C 将D中生成的CO2全部赶入A装置中 d 偏小
【解析】
I.亚铁离子具有还原性,能使酸性高锰酸钾溶液褪色,所以要证明样品中确实没有FeO其实验操作为I取少量样品于试管中,加入稀硫酸溶解,再加入少量KMnO4溶液,溶液不褪色,说明样品中没有FeO。。
Ⅱ.(1)盛装盐酸的仪器的名称是分液漏斗。要测定氧化铁的质量分数需要利用碳酸镁与盐酸反应生成CO2,通过测量CO2来计算碳酸镁,进而计算氧化铁的质量分数。为保证产生的CO2全部进入氢氧化钡溶液中,需要利用空气,又因为空气中也含有水蒸气和CO2,所以装置的连接顺序是 B→D→A→C。
(2)根据以上分析可知实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物以实现充分反应外,还有一个重要作用是将D中生成的CO2全部赶入A装置中。
(3)空气中含有CO2,所以为提高测定的准确度,需要把空气中的CO2除去。因此在B中最应加入的物质是NaOH溶液。
(4)由于反应中产生的CO2含有水蒸气,也能被氢氧化钡溶液吸收,导致测定的碳酸镁质量偏高,因此若用此法测得Fe2O3的质量分数将偏小。


科目:高中化学 来源: 题型:
【题目】布洛芬具有降温和抑制肺部炎症的双重作用。一种制备布洛芬的合成路线如下:
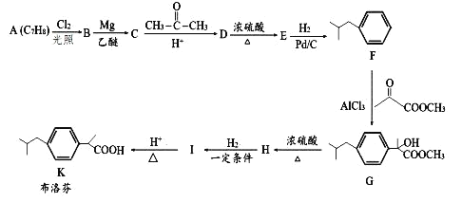
已知:①CH3CH2Cl![]() CH3CH2MgCl
CH3CH2MgCl![]()
![]()
②![]() +HCl
+HCl
回答下列问题:
(1)A 的化学名称为___________,E→F 的反应类型为___________,H 中官能团的名称为___________。
(2)分子中所有碳原子可能在同一个平面上的 E 的结构简式为___________。
(3)I→K 的化学方程式为___________。
(4)写出符合下列条件的 D 的同分异构体的结构简式___________ (不考虑立体异构)。
①能与 FeCl3 溶液发生显色反应; ②分子中有一个手性碳原子;③苯环上有处于间位的 2 个取代基。
(5)写出以间二甲苯、CH3COCl 和(CH3)2CHMgCl 为原料制备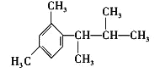 的合成路线__________ (无机试剂任选)
的合成路线__________ (无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
(Ⅰ)打开这种药片的密封膜,发现其外观为淡黄色;
(Ⅱ)将“速力菲”投入小试管中,加入少量蒸馏水,充分振荡后发现溶液变浑浊;慢慢加入稀硫酸后溶液变得澄清透明并显黄色;滴加KSCN溶液,立即变为血红色.学生甲由此断定“速力菲”的主要成分是三价铁盐;
(Ⅲ)学生乙的操作与甲大致相同,所不同的是他动作敏捷,且在振荡前用橡皮塞塞紧试管口.结果发现:溶液仅显示淡红色.乙同学认为“速力菲”的主要成分不是三价铁盐而是亚铁盐.
(Ⅳ)为了确认甲、乙的结论是否正确,学生丙将乙所得的淡红色溶液分成两份继续进行实验:
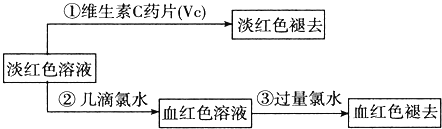
试回答下列问题:
(1)甲、乙两位同学的结论中比较合理的是 ______ ,另一同学判断出错的原因是 ______ .
(2)丙的实验①说明维生素C具有较强的 ______ 性![]() 填“氧化”或“还原”
填“氧化”或“还原”![]() .
.
(3)写出与丙的实验②中现象对应的离子反应方程式 ______;______ .
(4)关于丙的实验③中的现象,丙同学提出了两种假设:一种是过量的氯水与Fe3+结合生成了某种稳定的新物质;另一种则是过量的氯水将SCN-氧化了.请你设计一个实验方案以确认哪种假设更合理 ______ .
(5)针对实验目的,本次实验尚未完成的任务是 ______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期律可以指导人们进行规律性的推测和判断。下列说法错误的是( )
A.由水溶液的酸性:![]() 可推断出元素的非金属性:
可推断出元素的非金属性:![]()
B.若![]() 和
和![]() 的核外电子排布相同,则原子序数:
的核外电子排布相同,则原子序数:![]()
C.已知第ⅡA族元素的硫酸盐溶解性:![]() 易溶于水,
易溶于水,![]() 微溶于水,可推断出
微溶于水,可推断出![]() 难溶于水,但相同温度下
难溶于水,但相同温度下![]() 溶解度比
溶解度比![]() 的大
的大
D.![]() 和
和![]() 分别位于第六周期第ⅠA族和第ⅡA族,碱性:
分别位于第六周期第ⅠA族和第ⅡA族,碱性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】教材中给出了Na2O2与水反应的化学方程式,某学习小组通过实验研究Na2O2与水发反应机理
操作 | 现象 |
Ⅰ | 剧烈反应,产生的气体能使带火星木条复燃,固体全部溶解后,得到的无色溶液a |
Ⅱ | 溶液变红,10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
Ⅲ | 又有大量气泡产生,产生的气体也能使带火星木条复燃 |
(1)Na2O2的电子式为 ______ ,很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表示反应的机理,写出Na218O2与H2O反应的化学方程式 ______ .
(2)操作Ⅱ中红色褪去的可能原因是 ______ .
(3)用反应![]() 测定溶液a中H2O2含量.取20.00ml溶液a,用稀 ______
测定溶液a中H2O2含量.取20.00ml溶液a,用稀 ______ ![]() 填化学式
填化学式![]() 酸化,用0.002molL-1KMnO4溶液滴定,至终点时平均消耗10.00ml KMnO4溶液.滴定时KMnO4溶液应装在 ______
酸化,用0.002molL-1KMnO4溶液滴定,至终点时平均消耗10.00ml KMnO4溶液.滴定时KMnO4溶液应装在 ______ ![]() 填酸或碱
填酸或碱![]() 式滴定管中,终点确定的方法是 ______ ,经计算溶液a中c(H2O2)= ______ molL-1
式滴定管中,终点确定的方法是 ______ ,经计算溶液a中c(H2O2)= ______ molL-1
(4)向溶液a中滴加FeSO4溶液,发生反应的离子方程式为______ .
(5)向FeSO4溶液中加入一定量Na2O2固体,并以物质的量为2:1发生反应,反应中无气体生成,写出反应的离子方程式 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA是强酸
B. 该混合液pH=7
C. 图中x表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是两种具有相同分子式的有机物—邻羟基苯甲酸和对羟基苯甲酸的结构式。已知它们的沸点相差很大,你认为哪一种沸点较高?______________,如何从氢键的角度来解释?______________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为X,在一定条件下X可分别转化为Y、Z。
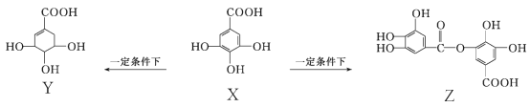
下列说法错误的是
A. 1 mol Z最多能与8 mol NaOH发生反应
B. 1 mol X与H2完全加成产物的分子式为C7H12O5
C. 向Y中滴加FeCl3溶液呈紫色
D. 1 mol Y与足量的金属钠反应放出2 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1 L0.1 mol·L-1 氨水中含有0.1NA NH3分子
B.46 g NO2和N2O4混合气体中含有的原子数为3NA
C.1 mol Na2O2中含有的阴离子数为2NA
D.常温常压下,12 g14C所含中子数为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com