
下列是实验操作与预期实验目的或所得实验结论,正确的填(√)错误的填(×)
| 选项 | 实验操作 | 实验目的或结论 | 判断 |
| ① | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 说明该钾盐是 | |
| ② | 向某溶液中加入盐酸,无明显现象,再向其中加入BaCl2溶液有白色淀沉淀产生 | 证明该溶液中有 SO42— | |
| ③ | 向淀粉溶液中加入一定量的稀硫酸加热,再加入一定量的新制氢氧化铜加热。 | 证明淀粉水解产生葡萄糖 | |
| ④ |  与浓硫酸170℃共热,制得的气体通人酸性 与浓硫酸170℃共热,制得的气体通人酸性 溶液 溶液 | 检验制得气体是否为乙烯 | |
(每空1分,共4分)①×,②√,③×,④×
解析试题分析:①不正确,HCO3―+H+=H2O+CO2↑,所以结论不正确,还可能是KHCO3;②正确,向某溶液中加入盐酸,无明显现象,排除Ag+的干扰,排除CO32―、SO32―、PO43―等的干扰;③不正确,加入一定量的新制氢氧化铜之前必须用NaOH溶液将反应混合物中的硫酸中和掉,否则会发生Cu(OH)2+H2SO4=CuSO4+2H2O,没有Cu(OH)2与葡萄糖反应,得不到砖红色的沉淀;④不正确,浓硫酸具有强氧化性,制乙烯的过程中可能产生SO2,具有还原性,也能使酸性 溶液褪色,另外乙醇蒸汽也能使酸性
溶液褪色,另外乙醇蒸汽也能使酸性 溶液褪色。
溶液褪色。
考点 :物质的检验


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:实验题
实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。




请回答下列问题:
(1)图甲中冷凝水从_________(a或b)进,图乙中B装置的名称为____________
(2)反应中加入过量的乙醇,目的是_________________________________________
(3)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:
则试剂a是:____________, 试剂b是____________ , 分离方法III是___________。
(4)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯得到乙酸乙酯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙两人蒸馏产物结果如下:甲得到了显酸性的酯的混合物,乙得到了大量水溶性的物质。丙同学分析了上述实验目标产物后认为上述实验没有成功。试解答下列问题:ks5u
① 甲实验失败的原因是:_______________________________________________
② 乙实验失败的原因是:_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
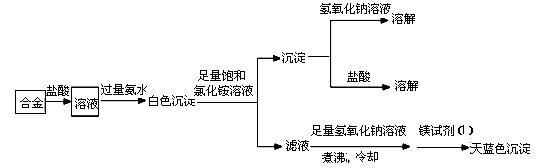
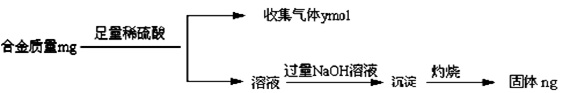
某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】探究该焰火原料的组成
【资料检索】①Mg2+检验方法:取2滴待检液,加入2滴2mol·L-1NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+检出
②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵
③很多合金是金属互化物,有确定的化学组成
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。
| 试验序号 | 实 验 步 骤 | 实 验 现 象 | 结 论 |
| ① | 取少量该焰火原料加入冷水 | 无明显现象 | ________________ |
| ② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体 | _________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室可以用MgCl2?6H2O为原料制备碳酸镁晶须,主要流程如下:
试回答:
(1)操作1的名称是_______。
(2)上述反应过程要控制好温度,因为MgCO3置于水中长时间加热煮沸可完全生成Mg(OH)2,其原因是_____________________。
(3)另査阅文献,在加热煮沸时也可能生成碱式碳酸镁Mg5(OH)2(CO3)4·4H2O,写出该反应的化学方程式______________。
(4)某课题组为了确定MgCO3在水中长时间加热煮沸后所得的固体成分,进行如下研究。(注:Mg(OH)2, Mg5(OH)2(CO3)4.4H2O在煮沸时均不会分解)
①定性研究:请你完成下表中内容。
| 实验步骤 | 预期的实验现象和结论 |
| 取一定质量的固体样品 | 若 ,则固体产物为Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组以工业碳酸钙(含少量Al2O3、Fe2O3、SiO2等杂质)生产二水合氯化钙晶体(CaCl2·2H2O)的操作流程为:
(1)CaCO3与盐酸反应的离子方程式 。
(2)加入氢氧化钙溶液调节溶液的pH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 ,若用氢氧化钠溶液除杂则产品中可能混有的物质为 。
(3)酸化时加盐酸将溶液的pH调节到4.0左右,其主要目的是 。
(4)操作Ⅰ中应包括①蒸发浓缩②冷却结晶③过滤④ ⑤ 等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取7.350 g样品配成200.0 mL溶液,与205.0 mL 0.5000 mol/LAgNO3溶液恰好完全反应。
①样品中CaCl2·2H2O的质量分数为 。
②若计算出结果有明显偏差,你认为在操作Ⅰ的五个步骤中由 引起的(填序号),理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体。
完成下列填空:
(1)气体A中的大气污染物可选用下列试剂中的 (填序号)吸收。
a. 浓H2SO4 b. 浓HNO3 c. NaOH溶液 d. 氨水
(2)用稀H2SO4 浸泡熔渣B,取少量所得溶液,滴加 (填物质名称)溶液后呈红色,说明溶液中存在Fe3+,检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
|

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
以钡矿粉(主要成份为BaCO3,含有Ca2+、Fe2+、Fe3+、Mg2+等)制备BaCl2·2H2O的流程如下: 
(1)氧化过程主要反应的离子方程式为 。
(2)沉淀C的主要成分是Ca(OH)2和 。由图可知,为了更好的使Ca2+沉淀,还应采取的措施为 。

(3)用BaSO4重量法测定产品纯度的步骤为:
步骤1:准确称取0.4~0.6 g BaCl2·2H2O试样,加入100 ml 水,3 ml 2 mol·L-1的HCl溶液加热溶解。
步骤2:边搅拌,边逐滴加入0.1 mol·L-1 H2SO4溶液。
步骤3:待BaSO4沉降后, ,确认已完全沉淀。
步骤4:过滤,用0.01 mol·L-1的稀H2SO4洗涤沉淀3~4次,直至洗涤液中不含Cl-为止。
步骤5:将折叠的沉淀滤纸包置于 中,经烘干、炭化、灰化后在800℃灼烧至恒重。称量计算BaCl2·2H2O中Ba2+的含量。
①步骤3所缺的操作为 。
②若步骤1称量的样品过少,则在步骤4洗涤时可能造成的影响为 。
③步骤5所用瓷质仪器名称为 。滤纸灰化时空气要充足,否则BaSO4易被残留的炭还原生成BaS,该反应的化学方程式为 。
④有同学认为用K2CrO4代替H2SO4作沉淀剂效果更好,请说明原因 。
[已知:Ksp(BaSO4)=1.1×10-10 Ksp(BaCrO4)=1.2×10-10]
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用硫酸厂烧渣(主要成分为Fe2O3及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4?7H2O),有关的工艺流程如下:
(1)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是___________(填编号);
| A.品红溶液 | B.紫色石蕊溶液 |
| C.酸性KMnO4溶液 | D.溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是产生和收集气体的实验装置,该装置不适合于 
| A.用锌和盐酸制取H2 |
| B.用NH4Cl和Ca(OH)2制取NH3 |
| C.用电石和饱和食盐水制取C2H2 |
| D.用H2O2在MnO2催化下制O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com