
实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。




请回答下列问题:
(1)图甲中冷凝水从_________(a或b)进,图乙中B装置的名称为____________
(2)反应中加入过量的乙醇,目的是_________________________________________
(3)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:
则试剂a是:____________, 试剂b是____________ , 分离方法III是___________。
(4)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯得到乙酸乙酯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙两人蒸馏产物结果如下:甲得到了显酸性的酯的混合物,乙得到了大量水溶性的物质。丙同学分析了上述实验目标产物后认为上述实验没有成功。试解答下列问题:ks5u
① 甲实验失败的原因是:_______________________________________________
② 乙实验失败的原因是:_______________________________________________
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:实验题
硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;②2B+6HCl 2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
【设计实验】 某同学设计如图所示装置制备三氯化硼:
请回答下列问题:
(1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方程式:___________________________________。
(2)E装置的作用是_______________________________________________。
如果拆去B装置,可能的后果是______________________________________
(3)写出D装置中发生反应的化学方程式:_____________________________
实验中可以用一个盛装________(填试剂名称)的干燥管代替F+G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:__________________________________________________________;
实验室保存三氯化硼的注意事项是_________________________________。
(5)为了顺利完成实验,正确的操作是________(填序号),并解释原因:________。
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你设计一个简易实验,验证制得的产品中是否含有硼粉:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,该晶体具有Na2CO3和H2O2的双重性质。利用图-2装置制备过碳酸钠,在冷水浴中充分反应后,按图-1流程可获得过碳酸钠产品。

(1)恒压滴液漏斗中支管的作用是 。
(2)制备过碳酸钠的关键是 。
(3)如果配制过碳酸钠的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用。试分析其中的原因(写出其中一种即可,用方程式表示)。________________________________;
(4)某化学学习小组为了定性探究铁离子对这种新型漂白剂的不良影响,取该漂白剂100mL,加入25g FeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请选用下列试剂和实验用品完成气体成分的探究过程:0.1mol/LNaOH溶液、8.0mol/LNaOH溶液、澄清石灰水、0.01mol/LKMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、木条、酒精灯、火柴、洗气瓶。
①提出假设:对该气体成分提出合理假设。
假设1:气体是O2; 假设2:气体是______________; 假设3:气体是CO2。
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论:
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有_______、________的洗气瓶中,________________________。 | ①________________________ ②________________________ ③________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组拟探究在含Mg2+、Al3+ 的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程。
【实验】在0.1 mol?L-1 MgSO4、0.05 mol?L-1Al2(SO4)3的混合溶液中滴加0.5 mol?L-1NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示。
(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于 (填仪器名称)中滴加。
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是 。
(3)对第二阶段(b、c之间)溶液pH变化缓慢的本质,小组同学做出如下推测,请补充推测2和3:
推测1:生成Mg(OH)2沉淀,消耗OH-;
推测2: ;
推测3: 。
若推测1符合实际情况,则a点之前反应的离子方程式为 ,请据此描述Mg(OH)2、Al(OH)3两种物质在水溶液中溶解性的差异 。
(4)请分析e点后溶液中较大量存在的含金属元素的离子并设计实验检验(可不填满):
| 较大量存在的含金属元素的离子 | 检验方法 |
| | |
| | |
| | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
过碳酸钠(2Na2CO4·3H2O)是一种新型高效固体漂白杀菌剂,它具有无臭、无毒、无污染的特点,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中。依托纯碱厂制备过碳酸钠可降低生产成本,其生产流程如下:
试回答下列问题:
(1)过碳酸钠溶于水后所得溶液显 (填“酸性”、“碱性”或“中性”)。请用离子方程式表示:______________________。
(2)操作①需要的玻璃仪器有 (填写仪器名称)。
(3)工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。
①要检验工业纯碱中杂质的存在,最好选用下列试剂中的__________(选填序号)。
a. 氢氧化钡溶液 b. 稀硝酸 c. 硫氰化钾溶液 d. 硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若观察到 说明装置不漏气。
③装置A的作用是 ,装置C中的试剂为 。
④某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要? (选填“必要”或“不必要”),判断的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物。(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出。请回答下列问题: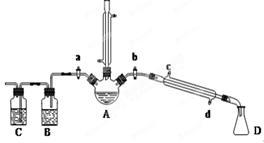
(1)仪器D的名称是 。
(2)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。写出该反应的化学方程式 。
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢等。熄灭A处酒精灯,在竖直冷凝管上方塞上塞子,打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是 、 。
(4)在实验过程中,发现A中液体由无色逐渐变成黑色,该黑色物质与浓硫酸反应的化学方程式为 ,可在竖直冷凝管的上端连接一个内装吸收剂碱石灰的干燥管,以免污染空气。
(5)相关有机物的数据如下:
| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式: 。
(2)上图装置中NaOH溶液的作用是_ 。反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有___ _(填写化学式)。
(3)步骤二中,水浴加热所需仪器有__ _、_ (加热、夹持仪器、石棉网除外);
(4)步骤二的滤液中可能含有CO32-,写出检验CO32-的方法:
(5)影响产品产量的主要因素有__ __。
(6)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是___ _。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
【材料一】苏教版《化学1(必修)》工业上从海产品(海带)中获取碘的流程图如下:
(1)上述生产流程的第一步是“浸泡”,它的实验目的是 ;
(2)“氧化”这一操作中可供选用的试剂:Cl2、Br2、浓硫酸和H2O2(滴加稀硫酸),从无污染角度考虑,请你选择的合适试剂 ;
(3)上述的生产流程中,“提纯获得单质碘”一般认为经历两步,你认为应选择下图实验装置分别是( )( ) (按操作的先后顺序填写);


 【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:
【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:
(4)实际工业生产中,酸化、氧化的方法是先加入硫酸酸化,使pH降低到2,然后加入次氯酸钠一类的氧化剂,使碘离子氧化。工业通常不用氯气氧化原因是(用离子方程式表示)
;
(5)上述的生产流程中离子交换树脂是用碱性树脂吸附,再用亚硫酸钠一类还原剂解吸,请问树脂吸附的碘元素状态是 (填写“游离态”或“化合态”)。解吸后应加入 (填写下列编号:A.氧化剂、B.还原剂)可以实现碘析。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下列是实验操作与预期实验目的或所得实验结论,正确的填(√)错误的填(×)
| 选项 | 实验操作 | 实验目的或结论 | 判断 |
| ① | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 说明该钾盐是 | |
| ② | 向某溶液中加入盐酸,无明显现象,再向其中加入BaCl2溶液有白色淀沉淀产生 | 证明该溶液中有 SO42— | |
| ③ | 向淀粉溶液中加入一定量的稀硫酸加热,再加入一定量的新制氢氧化铜加热。 | 证明淀粉水解产生葡萄糖 | |
| ④ |  与浓硫酸170℃共热,制得的气体通人酸性 与浓硫酸170℃共热,制得的气体通人酸性 溶液 溶液 | 检验制得气体是否为乙烯 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com