
NaCl是一种化工原料,可以制备一系列物质(见下图)。下列说法正确的是( )
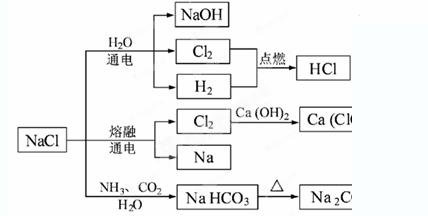
A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图4所示转化反应都是氧化还原反应
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
T ℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是
CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是
A.反应开始至a点时v(H2)=1 mol·L-1·min-1
B.若曲线Ⅰ对应的条件改变是升温,
则该反应H>0
C.曲线Ⅱ对应的条件改变是降低压强
D.T ℃时,该反应的化学平衡常数为0.125
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
A.碳酸钠的水解:CO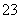 +2H2OH2CO3+2OH-
+2H2OH2CO3+2OH-
B.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O===AgOH↓+NH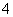
C.用惰性电极电解氯化镁溶液:2Cl-+2H+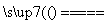 H2↑+Cl2↑
H2↑+Cl2↑
D.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+===I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1 mol•L-1FeCl2溶液:H+、Na+、Cl-、NO3-
B.c(OH-)=0.1 mol•L-1的溶液:K+、Na+、ClO-、NO3-
C.c(H+)=0.1 mol•L-1的溶液:K+、Na+、HCO3-、SO42-
D.与铝反应产生大量氢气的溶液:Ba2+、Na+、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.在某盐溶液中加入浓NaOH溶液,加热后如果生成气体使湿润的红色石蕊试纸变蓝,则原溶液一定是铵盐溶液
B.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
C.在某溶液中加入盐酸酸化的BaCl2溶液,如果生成白色沉淀,则原溶液中一定
有SO42—
D.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
⑴烟气脱硫、脱硝的环境意义是 。
⑵选择性催化还原法的脱硝原理为:6NOx+4x NH3 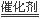 (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为 L。
②已知:2H2(g)+O2(g) =2H2O (g) ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=-180.5kJ·mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH= 。
⑶目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
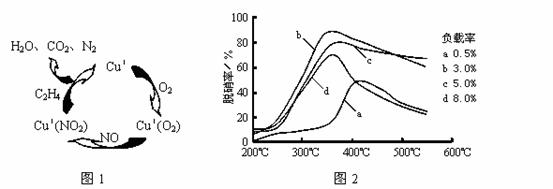
①写出该脱硝原理总反应的化学方程式: 。
②为达到最佳脱硝效果,应采取的条件是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其它材料电池。电池总反应为: 下列说法正确的是
下列说法正确的是
A.该电池充电时锂极与外电源的负极相连
B.电池在放电时,Li+向负极移动
C.该电池充电时阴极的反应为:LixV2O2-xe-=V2O2+xLi+
D.若放电时转移0.2mol电子,则用去的锂为1.4 x g
查看答案和解析>>
科目:高中化学 来源: 题型:
金属单质及其化合物与工农业生产、日常生活有密切的联系。
请回答下列问题:
(1) 一定温度下,氧化铁可以与一氧化碳发生如下反应:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H=Q kJ·mol-1,
2Fe(s)+3CO2(g) △H=Q kJ·mol-1,
①该反应的平衡常数表达式K= ;
②该温度时,在2 L盛有Fe2O3粉末的密闭容器中通人CO气体,5 min后,生
成了单质铁11.2 g,则这段时间内CO的反应速率为 ;
③达平衡后,若温度升高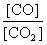 的值增大,则Q 0(填“>”、“=”、“<”)。
的值增大,则Q 0(填“>”、“=”、“<”)。
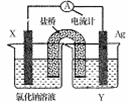 (2)依据氧化还原反应:Cu2+(aq)+Fe(s)= Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是 (填序号)。
(2)依据氧化还原反应:Cu2+(aq)+Fe(s)= Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是 (填序号)。
A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,X电极反应为:O2+2H2O+4e- 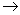 4OH-
4OH-
D.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
在给定条件下,下列加点的物质在化学反应中完全消耗的是( )
A.用50mL 12 mol·L-1的氯化氢水溶液与足量二氧化锰共热制取氯气
B.将1g铝片投入20mL 18.4 mol·L-1的硫酸中
C.向100mL 3 mol·L-1的硝酸中加入5.6g铁
D.常温常压下,0.1mol氯气通入1L水中反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com