
分析 若经过2s后测得SO3的浓度为0.6mol/L,物质的量=0.6mol/L×1L=0.6mol,利用三段式计算各组分的浓度变化量、2s时各组分的浓度,根据v=$\frac{△c}{△t}$计算v(O2),根据c=$\frac{n}{V}$计算浓度.
解答 解:(1)若经过2s后测得SO3的浓度为0.6mol/L,物质的量=0.6mol/L×1L=0.6mol;
2SO2(g)+O2(g)?2SO3 (g)
起始量(mol) 2 1 0
变化量(mol) 0.6 0.3 0.6
2s量(mol) 1.4 0.7 0.6
O2的化学反应速率V(O2)=$\frac{\frac{0.3mol}{1L}}{2s}$=0.15mol/(L.s),故答案为:0.15mol/(L.s);
(2)2s时的O2浓度=$\frac{0.7mol}{1L}$=0.7mol/L,故答案为:0.7mol/L.
点评 本题主要是反应速率的计算,掌握基础是关键,题目难度不大.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 将标准状况下112mL氯气通入10mL 1mol•L-1的溴化亚铁溶液:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| D. | 等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2++2HCO3-+2OH-═CaCO3+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
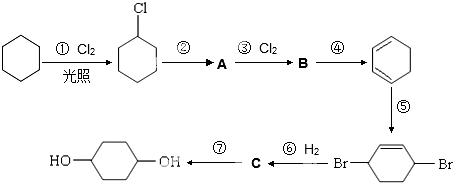
 ;
;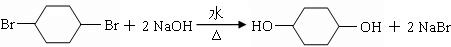 .
.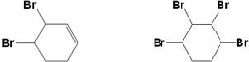 .
.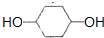 +O2$→_{△}^{催化剂}$
+O2$→_{△}^{催化剂}$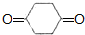 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
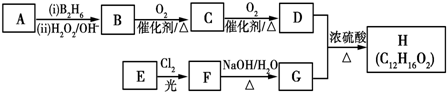
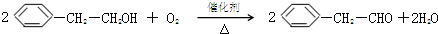 .
. .
.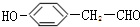 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 三氟化硼(BF3) | D. | 氮气 (N2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列关于该物质的说法正确的是( )
,下列关于该物质的说法正确的是( )| A. | 其分子式为C15H21O4 | |
| B. | 分子中只含有两种极性共价键 | |
| C. | 既能发生加聚反应,又能发生酯化反应 | |
| D. | 既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
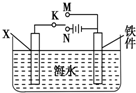 对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.
对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com