
【题目】(1)室温下在pH =5的醋酸稀溶液中, 醋酸电离出的c(H+)的精确值是__molL-1,水电离出的c(H+)是__molL-1。
(2)写出下列反应的离子方程式:①草酸溶液中滴入酸性高锰酸钾溶液___;
②铬酸钾溶液中滴入稀硫酸___;
(3)反应I2+2S2O32-=2I-+S4O62-常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择___(填序号)。
①1mL0.01molL-1的碘水 ②1mL0.001molL-1的碘水
③4mL0.01molL-1的Na2S2O3溶液 ④4mL0.001molL-1的Na2S2O3溶液
若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O32-)=__。
【答案】10-5-10-9 10-9 5H2C2O4+2MnO4-+ 6H+=2Mn2++10CO2↑+8H2O 2CrO42-+2H+=Cr2O72-+H2O ②③④ 8.3×10-4molL-1s-1
【解析】
(1)室温下在pH =5的醋酸稀溶液中,H+主要来自醋酸电离,但水也会发生电离,所以溶液中的c(H+)实际上是醋酸电离出的H+与水电离出的H+的浓度之和;在此醋酸溶液中水电离出的c(H+)与水电离出的c(OH-)相等,也等于溶液中的c(OH-);
(2)反应的离子方程式:①草酸溶液中滴入酸性高锰酸钾溶液,会发生氧化还原反应,H2C2O4被氧化为CO2,KMnO4中的锰被还原为Mn2+;
②铬酸钾溶液中滴入稀硫酸,CrO42-在酸性溶液中转化为Cr2O72-;
(3)要探究浓度对反应速率的影响,则反应物的浓度应该是不同的,根据反应方程式可知,如果选择试剂①,则④的Na2S2O3溶液不足量。因此我们选择②③④;
若某同学选取①③进行实验,则参加反应的Na2S2O3的物质的量为2mL×0.01molL-1,溶液的体积为6mL,测得褪色时间为4s,从而可计算出v(S2O32-)。
(1)室温下在pH =5的醋酸稀溶液中,H+主要来自醋酸电离,但水也会发生电离,所以溶液中的c(H+)实际上是醋酸电离出的c(H+)(即为10-5mol/L)与水电离出的c(H+)之和;在此醋酸溶液中水电离出的c(H+)与水电离出的c(OH-)相等,也等于溶液中的c(OH-)(即为10-9mol/L);因此醋酸电离出的c(H+)的精确值是(10-5-10-9)molL-1,水电离出的c(H+)是10-9molL-1;答案为:10-5-10-9;10-9;
(2)①草酸溶液中滴入酸性高锰酸钾溶液,会发生氧化还原反应,H2C2O4被氧化为CO2,C由+3价升高到+4价,KMnO4中的锰被还原为Mn2+,Mn由+7价降低到+2价,按电子守恒,有下列关系式,5H2C2O4—2KMnO4,反应的离子方程式为:
5H2C2O4+2MnO4-+ 6H+=2Mn2++10CO2↑+8H2O;答案为:5H2C2O4+2MnO4-+ 6H+=2Mn2++10CO2↑+8H2O;
②铬酸钾溶液中滴入稀硫酸,CrO42-转化为Cr2O72-,反应的离子方程式为2CrO42-+2H+=Cr2O72-+H2O;答案为:2CrO42-+2H+=Cr2O72-+H2O;
(3)要探究浓度对反应速率的影响,则反应物的浓度应该是不同的,根据反应方程式可知,如果选择试剂①,则④的Na2S2O3溶液不足量。因此我们选择②③④;
若某同学选取①③进行实验,则参加反应的Na2S2O3的物质的量为2mL×0.01molL-1,溶液的体积为6mL,测得褪色时间为4s,从而可计算出v(S2O32-)=![]() molL-1s-1。答案为:②③④;8.3×10-4molL-1s-1。
molL-1s-1。答案为:②③④;8.3×10-4molL-1s-1。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A(g)+B(g)![]() xC(g) △H<0。测得两容器中c(A)随时间t的变化如上图所示,下列说法不正确的是
xC(g) △H<0。测得两容器中c(A)随时间t的变化如上图所示,下列说法不正确的是
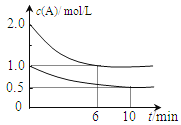
A.x=1
B.此条件下,该反应的平衡常数K=4
C.给乙容器升温可缩短反应达平衡的时间但不能提高平衡转化率
D.甲和乙的平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=12的氢氧化钠和pH=4的醋酸等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是
A.混合后的溶液呈中性B.混合前两溶液中水的电离程度不同
C.氢氧化钠和醋酸的浓度不相等D.混合前的醋酸约1%发生电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于治金、染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是
Na2S+2CO2↑。下列有关说法正确的是
A. 1L.0.25mol/L.Na2SO4溶液中含有的氧原子数目为NA
B. 1L.0.1mol/LNa2S溶液中含有的阴离子数目小于0.1NA
C. 生成1mol还原产物时转移电子数为8NA
D. 通常状况下,11.2L.CO2中含有的共价键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是
A. 2gD2O和H2l8O混合物中所含中子数为NA
B. 1L0.1mol·L-1 NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
C. 常温常压下,0.5 mol Fe和足量浓硝酸混合,转移电子数为1.5NA
D. 0.1 mol H2和0.1 mol I2 (g)于密闭容器中充分反应,其原子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol SO2和1 mol O2通入体积不变的密闭容器中,在一定条件下发生反应2SO2(g)+O2(g)![]() 2SO3(g),达到平衡时SO3为0.3 mol,此时若移走0.5 mol O2和0.5 mol SO2,相同温度下再次达到新平衡时SO3的物质的量为
2SO3(g),达到平衡时SO3为0.3 mol,此时若移走0.5 mol O2和0.5 mol SO2,相同温度下再次达到新平衡时SO3的物质的量为
A. 0.3 mol B. 0.15 mol
C. 小于0.15 mol D. 大于0.15 mol,小于0.3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇时,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1= -99kJmol-1
CH3OH(g) △H1= -99kJmol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2= 58kJmol-1
CH3OH(g)+H2O(g) △H2= 58kJmol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41kJmol-1
CO(g)+H2O(g) △H3=+41kJmol-1
(1)一定温度下,向体积为2L的密闭容器中加入CO和H2,假设只发生反应①,达平衡后测得各组分浓度如下:
物质 | CO | H2 | CH3OH |
浓度(molL-1) | 0.9 | 1.0 | 0.6 |
①列式并计算平衡常数K=___。
②若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是___。
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正__v逆(填“>”、“<”或“=”)。
(2)在实际生产中,当合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图所示。
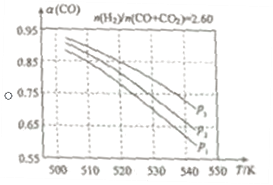
α(CO)值随温度升高而___(填“增大”或“减小”),其原因是___。图中的压强由大到小为___,其判断理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,一极通入空气,另一极通入丁烷气体,电解质是掺杂氧化钇![]() 的氧化锆
的氧化锆![]() 晶体,在熔融状态下能传导
晶体,在熔融状态下能传导![]() 。对该燃料的说法正确的是( )
。对该燃料的说法正确的是( )
A.在熔融电解质中,![]() 由负极移向正极
由负极移向正极
B.电池的总反应是:2C4H10+13O2![]() 8CO2+10H2O
8CO2+10H2O
C.通入空气的一极是正极,电极反应为:![]()
D.通入丁烷的一极是正极,电极反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应原理的应用叙述中,正确的是![]()
A.用明矾净水是因为![]() 水解生成的
水解生成的![]() 胶粒具有较强的吸附性
胶粒具有较强的吸附性
B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
C.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
D.为了防止钢铁锈蚀,把输油管的铸铁管连接外加直流电源的正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com