
【题目】t ℃时,水的离子积为Kw,该温度下将a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
A. 混合液中c(H+)=![]() B. 混合液的pH=7
B. 混合液的pH=7
C. a=b D. 混合液中c(B+)=c(A-)+c(OH-)
【答案】A
【解析】
根据溶液中c(H+)与c(OH-)的相对大小,可判断出溶液的酸碱性。题设中溶液呈中性,则其必要的条件是c(H+)=c(OH-),
A. 根据Kw=c(H+)·c(OH-),若溶液呈中性,则c(H+)=c(OH-),进而得出结论;
B. pH = -lgc(H+),其值只与c(H+)有关,不能直接判断出c(H+)是否与c(OH-)相等;
C. HA与BOH是否是强酸或强碱未知;
D. 该式不符合电荷守恒式。
题设中溶液呈中性,则其必要的条件是c(H+)=c(OH-),
A. 因Kw=c(H+)·c(OH-),若溶液显中性,则c(H+)=c(OH-),推出Kw = c2(H+),即c(H+)=![]() ,故A项正确;
,故A项正确;
B. pH = 7的溶液只有在25℃才是中性,在其他温度下溶液不是中性,则不是必要条件,故B项错误;
C. HA与BOH是否是强酸或强碱未知,则a=b时,HA与BOH恰好完全反应,但混合后生成的盐溶液不一定呈中性,故C项错误;
D. 根据电荷守恒等式知:c(H+)+c(B+)=c(A-)+c(OH-),故D项错误;
答案选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示关系,则下列有关叙述正确的是( )

A. H2A的电离方程式为H2A ![]() H++HA-,HA-
H++HA-,HA- ![]() H++A2
H++A2
B. pH=4的H2A水溶液中c(OH-)=10-12 mol·L-1
C. NaHA、NaHB的混合溶液中,阴离子有A2-、HA-、HB-、B2-、OH-
D. Na2B的水溶液能与H2A溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列事实不能说明NH3H2O为弱电解质的是
A. 0.1 molL-1 NH3H2O溶液的pH小于13
B. Al(OH)3在浓氨水中不能溶解
C. 相同条件下,浓度均为0.1 molL-1的NaOH溶液和氨水,氨水的导电能力弱
D. 向0.1 molL-1 NH3H2O溶液中加入MgCl2溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能证明甲酸(HCOOH,一元酸)为弱酸的是( )
A.0.1mol/L甲酸的pH为2.3
B.将pH=2的甲酸稀释100倍后,溶液的pH小于4
C.温度升高,溶液的导电能力增强
D.等体积等浓度的甲酸和HCl与足量的锌反应,产生等量的氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:
①此配合物中,铁离子价电子排布图为_____;
②此配离子中碳原子的杂化轨道类型为_____;
③此配离子中含有的化学键为_____。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为_____,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是_____。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是_____。

(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒_____(请写一个分子和一个离子)。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为_____,已知晶胞密度为ρ g/cm3,则相邻2个b微粒之间的距离为_____nm(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是

A. t2时加入了催化剂 B. t3时降低了温度
C. t5时增大了压强 D. t4~t5时间内转化率一定最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车发动机工作时会产生包括CO、NOx等多种污染气体,涉及到如下反应:
①N2(g)+O2(g)![]() 2NO(g)
2NO(g)
②2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
③NO2(g)+CO(g)![]() CO2(g)+NO(g)
CO2(g)+NO(g)
弄清上述反应的相关机理,对保护大气环境意义重大,回答下列问题:
(1)请根据下表数据填空:N2(g)+O2(g) ![]() 2NO(g) △H=________。
2NO(g) △H=________。
物质 | N2 | O2 | NO |
能量(kJ) | 946 | 497 | 811.25 |
(断开1mol物质中化学键所需要的能量)
(2)实验测得反应2NO(g)+O2(g)![]() 2NO2(g) △H<0的即时反应速率满足以下关系式:
2NO2(g) △H<0的即时反应速率满足以下关系式:
v正=k正·c2(NO)·c(O2);v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响
①温度为T1时,在1L的恒容密闭容器中,投入0.6 molNO和0.3 molO2达到平衡时O2为0.2 mol;温度为T2时,该反应存在k正=k逆,则T1_______ T2 (填“大于”、“小于”或“等于”)。
②研究发现该反应按如下步骤进行:
第一步:NO+NO![]() N2O2 快速平衡 第二步:N2O2 +O2
N2O2 快速平衡 第二步:N2O2 +O2![]() 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v1正=k1正×c2(NO);v1逆=k1逆×c(N2O2)
下列叙述正确的是______
A.同一温度下,平衡时第一步反应的![]() 越大反应正向程度越大
越大反应正向程度越大
B.第二步反应速率低,因而转化率也低
C.第二步的活化能比第一步的活化能低
D.整个反应的速率由第二步反应速率决定
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g) =4CO2(g)+N2(g) △H<0
某温度下,向10L密闭容器中分别充入0.1molNO2和0.2 molCO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
回答下列问题:
①在此温度下,反应的平衡常数Kp=_________kPa-1(Kp为以分压表示的平衡常数,计算结果精确到小数点后2位);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡_____(填“右移”或“左移”或“不移动”);
②若将温度降低,再次平衡后,与原平衡相比体系压强(p总)如何变化?_______(填“增大”、“减小”或“不变”),原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9 日中国科学院正式向社会发布113号、115号、117号和118号元素的中文名称。已知117号元素有多种原子,如![]() 、
、![]() 等。下列说法正确的是( )
等。下列说法正确的是( )
A.![]() 和
和![]() 的化学性质不同
的化学性质不同
B.Ts位于周期表的第六周期ⅦA族
C.元素Ts的相对原子质量为293.5
D.![]() 和
和![]() 质子数相同,中子数不同
质子数相同,中子数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱除烟气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)以漂粉精溶液为吸收剂脱除烟气中的NO,相关热化学方程式如下:
ⅰ.4NO(g) + 3O2(g) + 2H2O(l) = 4HNO3(aq) H1 =﹣423 kJ·mol-1
ⅱ.Ca(ClO)2(aq) = CaCl2(aq) + O2(g) H2 =﹣120 kJ·mol-1
ⅲ.3Ca(ClO)2(aq) + 4NO(g) + 2H2O(l) = 4HNO3(aq) + 3CaCl2(aq) H3
① H3 = _______kJ·mol-1 。
② 反应ⅲ的平衡常数随温度升高的变化趋势是________。
(2)HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。C12和Ca(OH)2制取漂粉精的化学方程式是________。
(3)次氯酸盐脱除NO的主要过程如下:
a.NO+HClO = NO2+HCl
b.NO + NO2+H2O 2HNO2
c.HClO+ HNO2 = HNO3+HCl
下列分析正确的是________。
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
(4)研究不同pH、不同温度下漂粉精溶液对NO脱除率的影响,结果如图1、图2。
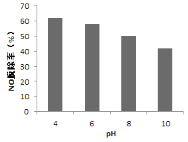

图1 图2
① 图1中,pH降低NO脱除率增大的原因:________。
② 脱除过程中往往有Cl2产生,原因是________(用离子方程式表示)。
③ 图2中,60~80℃ NO脱除率下降的原因:________。(至少答出两点)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com