
【题目】研究和深度开发CO、CO2的应用对建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ΔH1=+489.0kJmol-1,
C(s)+CO2(g)=2CO(g) △H2=+172.5kJmol-1
则CO还原Fe2O3(s)的热化学方程式为____________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________________。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
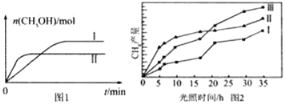
①线Ⅰ、Ⅱ对应的平衡常数大小关系为KI______KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为____________。
(4)利用光能和光催化剂,可将CO2和H2(g)转化为CH4和O2,紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为_____________(填序号)
(5)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
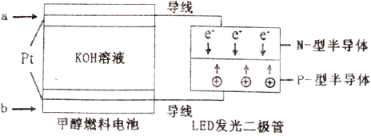
请写出加入(通入)b物质一极的电极反应式________________;每消耗6.4g甲醇转移的电子数为_______________。
(6)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将amol/L的醋酸与bmol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为__________________。
【答案】 Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH= -28.5kJ·mol-1 CO+4OH--2e-=CO32-+2H2O > 0.4<n(c)≤1mol Ⅱ>Ⅲ>I O2+4e-+2H2O=4OH- 1.2NA或1.2mol
2Fe(s)+3CO2(g) ΔH= -28.5kJ·mol-1 CO+4OH--2e-=CO32-+2H2O > 0.4<n(c)≤1mol Ⅱ>Ⅲ>I O2+4e-+2H2O=4OH- 1.2NA或1.2mol ![]()
【解析】(1)根据盖斯定律,由已知热化学方乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数并进行相应的加减,据此计算;
(2)CO燃料电池中,负极上是CO发生失电子的氧化反应,正极上是氧气发生得电子的还原反应,据此书写电极反应式;
(3)①Ⅱ比Ⅰ的甲醇的物质的量少,根据K=![]() 分析判断;②根据平衡三部曲求出甲中平衡时各气体的物质的量,然后根据平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行来判断范围;
分析判断;②根据平衡三部曲求出甲中平衡时各气体的物质的量,然后根据平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行来判断范围;
(4)相同时间甲烷的物质的量的变化量越大,表明平均速率越大,相同时间甲烷的物质的量的变化量越小,平均反应速率越小,据此分析解答;
(5)根据电子移动的分析判断出正负极,负极上甲醇失去电子发生氧化反应,正极上氧气得到电子发生还原反应;根据电子与甲醇的物质的量关系计算;
(6)通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,根据醋酸电离平衡常数K=![]() 计算。
计算。
(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol;②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ/mol;由①-②×3,得到热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol,故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
(2)CO燃料电池中,负极上是CO发生失电子的氧化反应,电极反应式为:CO+4OH--2e-=CO32-+2H2O,正极上是氧气发生得电子的还原反应,电极反应式为:O2+4e-+2H2O=4OH-,故答案为:CO+4OH--2e-=CO32-+2H2O;
(3)①平衡时,Ⅱ比Ⅰ的甲醇的物质的量少,则二氧化碳和氢气的物质的量越多,根据K=![]() 知,平衡常数越小,故KⅠ>KⅡ,故答案为:>;
知,平衡常数越小,故KⅠ>KⅡ,故答案为:>;
② CO2(g)+3H2(g)CH3OH(g)+H2O(g)
初始(mol) 1 3 0 0
平衡(mol) 1-x 3-3x x x
甲中平衡后气体的压强为开始时的0.8倍,即![]() =0.8,解得x=0.4mol,依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<n(c)≤1mol,故答案为:0.4<n(c)≤1mol;
=0.8,解得x=0.4mol,依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<n(c)≤1mol,故答案为:0.4<n(c)≤1mol;
(4)由图2可知,在0~15h内,甲烷的物质的量变化量为△n(Ⅰ)<△n(Ⅲ)<△n(Ⅱ),故在0~15h内,CH4的平均生成速率v(Ⅱ)>v(Ⅲ)>v(Ⅰ);故答案为:II>III>I;
(5)根据图示可知,电子由a电极经导线流向b电极,因此a为负极,b为正极,该电池负极是甲醇失电子生成碳酸钾,正极上是空气中的氧气得到电子生成氢氧根离子,电极反应式为O2+4e-+2H2O=4OH-;每消耗6.4g 甲醇的物质的量=![]() =0.2mol,反应中甲醇中的碳元素由-2价变成+4价,转移电子的物质的量为1.2mol,故答案为:O
=0.2mol,反应中甲醇中的碳元素由-2价变成+4价,转移电子的物质的量为1.2mol,故答案为:O
(6)通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数K=![]() =
=![]() =
=![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】准确量取 25.00mL KMnO4溶液,可选用的仪器是 ( )
A.25mL 量筒B.25mL 滴定管
C.25mL 容量瓶D.有刻度的 50mL 烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将一定质量的锌粒投入100mL 18.5mol/L的浓硫酸中,待锌粒完全溶解后,测得生成的H2和SO2共33.6L(标准状况),此时溶液中尚余0.1mol H+.计算可知:
①投入锌粒的质量为_____________g。
②生成的H2和SO2的物质的量之比为_____________。
(2)取25.6 g Cu与一定量的某浓度的浓HNO3反应,当铜完全溶解后,收集到产生的NO和NO2混合气体在标准状况下的体积共11.2 L,则:
①消耗硝酸的物质的量为_____________mol。
②NO的物质的量为_____________mol,NO2的物质的量为_____________mol。
③当铜完全溶解时,反应中转移的电子数目为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应H2(g) +I2(g)![]() 2HI(g)中,每生成2 mol HI时会有a kJ 的能量放出,又知有关化学键键能如下:
2HI(g)中,每生成2 mol HI时会有a kJ 的能量放出,又知有关化学键键能如下:
![]()
下列说法正确的是
A. 1mol H2 的能量比2 mol H 的能量高
B. 将0.5 mol H2 与1mol I2(g)混合充分反应后放出的热量为0.5a kJ
C. H- I键的键能为0.5(a+b+c) kJ/mol
D. H +I![]() HI 是吸热变化
HI 是吸热变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、X、Y、Z的原子序数依次递增,R的无氧酸溶液能在玻璃容器上刻标记;R和X能形成XR3型化合物,X在化合物中只显一种化合价;R和Z位于同主族,Y原子最外层电子数等于电子层数的2倍。下列有关推断正确的是
A. R单质和Z单质均可与水发生反应置换出O2
B. 上述元素形成的简单离子都能促进水的电离平衡
C. YR6能在氧气中剧烈燃烧
D. 元素对应的简单离子的半径:Y>Z>R>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是( )
A.未洗涤烧杯和玻璃棒
B.转移溶液前溶液未冷却至室温
C.容量瓶未干燥
D.定容时俯视液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周杰伦在歌曲《青花瓷》中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中的铜绿指的是( )
A. Cu2(OH)2CO3 B. Cu(OH)2 C. CuO D. Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、Fe2O3和CuO混合物投入100 mL浓度2.2 mol/L的硫酸溶液中,充分反应后生成896 mL标准状况下的气体,得不溶物1.28 g,过滤后,溶液中阳离子只有Fe2+,向滤液中加入2 mol/L的NaOH溶液,加至40 mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为100 mL( )
A.2 mol/L B.1.8 mol/L C.1.9 mol/L D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应N2O4(g) ![]() 2NO2(g)的焓变为ΔH。现将1mol N2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是( )
2NO2(g)的焓变为ΔH。现将1mol N2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是( )
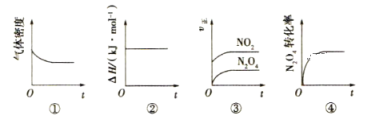
A. ①②B. ②④C. ③④D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com