
【题目】于可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡状态时,4v正(O2)=5v逆(NO)
B. 单位时间内断裂4 mol N—H的同时,断裂6mol O—H,反应达化学平衡状态
C. 达到化学平衡状态后,增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率的关系为2v正(NH3)=3v正(H2O)
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】由反应物X转化为Y和Z的能量变化如图所示。下列说法不正确的是( )

A. 方程式2X=3Y △H=E3-E2 B. X、Y、Z的能量从大到小为Y>X>Z
C. 降低压强有利于提高Y的产率 D. 降低温度有利于提高Z的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于酸、碱、盐的下列各种说法中正确的是( )
A. 水溶液中能电离出氢离子的化合物都是酸
B. 水溶液中能电离出氢氧根离子的化合物都是碱
C. 水溶液中不能电离出金属阳离子的氯化铵不是盐
D. 水溶液中能电离出金属阳离子和酸根离子的化合物是盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用盐酸和硝酸银探究铁、铜、银的金属活动顺序,下列实验可以不需要进行的是( )
A. 铁+稀盐酸 B. 铜+稀盐酸 C. 银+稀盐酸 D. 铜+硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第33号元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)砷在元素周期表中的位置是__________________________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_________________________________________。该反应需要在加压下进行,原因是__________________________。
(3)已知:2As(s)+3H2(g)+4O2(g)=2H3AsO4(s)△H1
H2(g)+ ![]() O2(g)=H2 O(l) △H2
O2(g)=H2 O(l) △H2
2As(s)+ ![]() O2(g) =As2O5(s)△H3
O2(g) =As2O5(s)△H3
则反应 As2O5(s) +3H2O(1)= 2H3AsO4(s)的△H=____________。
(4)298K时,将20mL3xmol·L-1Na3AsO3、20 mL 3xmol·L-1I2和20mL NaOH溶液混合,发生反应:AsO33-(aq)+I2+2OH-![]() AsO43-+2I-+H2O。溶液中c(AsO43-) 与反应时间(t)的关系如图所示。
AsO43-+2I-+H2O。溶液中c(AsO43-) 与反应时间(t)的关系如图所示。
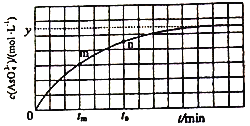
①下列不能判断反应达到平衡的是________(填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.c(AsO43-)/c(AsO33-)不再变化 d.c(I-)=ymol·L-1
②tm时v逆 ______tn时v逆(填“>”“<”或“=”),理由是_____________。
③若平衡时溶液的c(OH-)=lmol/L,则该反应的平衡常数K为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将新制的氢氧化铜溶液加入某人的尿液中,加热后,如果观察到砖红色沉淀出现,则此人尿液中含有( )
A. 食醋 B. 食盐 C. 葡萄糖 D. 蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,周期表的全部元素中X的原子半径最小,X与R的最外层电子数相等;Z的内层电子数是最外层电子数的一半,U的最高化合价和最低化合物的代数和为6;R和Q可形原子数之比为1:1和2:1的两种化合物;R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应. 请回答下列问题:
(1)T元素在期表中的位置是;由上述元素中的四种元素形成的既含有离子键又含有共价键的化合物为(写出其中一种物质的名称).
(2)X、Z、Q三种元素的原子半径由小到大顺序为(填元素符号).
(3)T、U两元素最高价氧化物对应的水化物反应的离子方程式为 .
(4)下列可以判断R和T金属性强弱的是(填序号). a.单质的熔点R比T低
b.单质与酸反应时,失电子数R比T少
c.单质与水反应R比T剧烈
d.最高价氧化物的水化物的碱性R比T强
(5)某同学用Q、R两元素的单质反应生成固体物质R2Q2 , R2Q2属于离子化合物,且能与化合物X2Q反应生成Q的单质.R2Q2的电子式为;R2Q2与X2Q反应的化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com