
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两种元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M层的电子数之和。
(1)A为________________(填元素名称,下同), C为___________;
(2)写出E的电子式_______________。
(3)A、B的一种化合物与E反应的化学方程式为_______________________;
(4)A、B两种元素形成的化合物属于____________(填“离子”或“共价”)化合物;
(5)D的最高价氧化物对应的水化物的浓溶液和A的单质反应的化学方程式为______________。
【答案】碳 钠 ![]() 2Na2O2+2CO2 =2Na2CO3+O2 共价 C+2H2SO4(浓)
2Na2O2+2CO2 =2Na2CO3+O2 共价 C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
【解析】
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层有4个电子,判断为C或硅,B的阴离子和C的阳离子有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,为过氧化钠,判断B为O,C为Na,D的L层电子数等于K、M两个电子层上的电子数之和,则判断为S,据此分析回答问题。
综上所述得到A、B、C和D分别为:C、O、Na、S,则
(1)A的元素名称为碳,C为钠;
(2)E为过氧化钠,其电子式为![]() ;
;
(3)A、B的化合物为二氧化碳,E为过氧化钠,二氧化碳与过氧化钠反应的化学方程式为:2Na2O2+2CO2 =2Na2CO3+O2;
(4)A、B两元素形成的化合物为二氧化碳,属于共价化合物,故答案为:共价;
(5)D的最高价氧化物的水化物为硫酸,A为碳,则浓硫酸和碳反应的化学方程式为:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) ⊿H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应⊿H1、⊿H2、⊿H3的关系正确的是( )
A. ⊿H1>⊿H2>⊿H3 B. ⊿H1<⊿H3<⊿H2 C. ⊿H1<⊿H2<⊿H3 D. ⊿H1>⊿H3>⊿H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
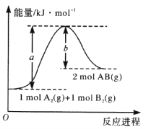
A. 每生成2 mol AB吸收bkJ热量
B. 该反应热△H= + (a-b)kJ mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法不正确的是
A. Cu2+是H2O2分解反应的催化剂 B. H2O2只表现了氧化性
C. H2O2的电子式为: ![]() D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下 列叙述不正确的是( )

A. 若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛Na2SiO3,则C中溶液中变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 实验仪器D可以起到防止溶液倒吸的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
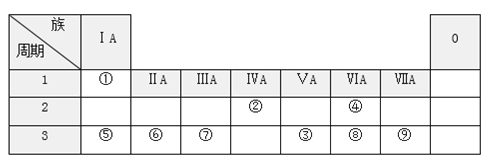
请按要求回答下列问题:
(1)元素⑦的原子结构示意图______________________。由②、④两种元素组成的化合物是___________化合物(填“共价”或“离子”)
(2)元素①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式__________________ ;一种离子化合物的化学式_________
(3)④⑤⑥三种元素的离子半径由大到小的顺序是____________(填离子符号)。
(4)⑧和⑨两种元素的最高价氧化物对应的水化物中酸性较弱的是________(填化学式)。
(5)元素③的气态氢化物和元素⑧的气态氢化物更稳定的是___________(填化学式)。
(6)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应水化物反应,其离子方程式为_________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应进行的方向和限度是化学反应原理所要研究的两个重要问题,下列有关化学反
应进行的方向和限度的说法中正确的是( )
A. mA(g)+nB(g)![]() pC(g),平衡时A的浓度等于0.5 mol/L,将容器体积扩大一倍,达到新的平衡后A的浓度变为0.3mol/L,则计量数m+n<p
pC(g),平衡时A的浓度等于0.5 mol/L,将容器体积扩大一倍,达到新的平衡后A的浓度变为0.3mol/L,则计量数m+n<p
B. 将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中,在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判断的依据
2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判断的依据
C. 对于反应A(g)+B(g)![]() 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变
2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变
D. 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期数与主族序数相等。
请回答下列问题:
![]()
(1)W在周期表中的位置是___________________________________,Q、R、T三种元素原子半径由大到小的顺序为________________________________。(用元素符号表示),
(2)QO2的电子式为_______________,R的最高价氧化物的化学式___________。
(3)T单质与NaOH 溶液反应的离子方程式为______________________
(4)T单质与W最高价氧化物的水化物溶液反应的离子方程式为_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 50 | 120 | 232 | 290 | 310 |
①哪一时间段反应速率最大:_____min(填0~1、1~2、2~3、3~4、4~5),原因是________。
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率___________________ (设溶液体积不变)。
(2)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
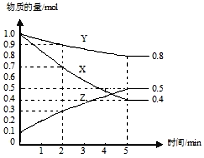
①该反应的化学方程式是___________。
②该反应达到平衡状态的标志是________
A.X的浓度不再改变
B.生成1mol Y的同时消耗2mol Z
C.Y的体积分数在混合气体中保持不变
D.容器内气体的总质量保持不变
③2min内Y的转化率为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com