
【题目】下表是元素周期表的一部分,请回答有关问题:
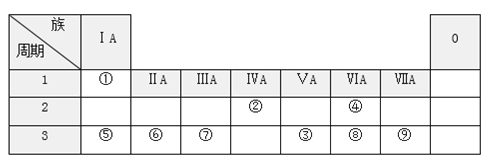
请按要求回答下列问题:
(1)元素⑦的原子结构示意图______________________。由②、④两种元素组成的化合物是___________化合物(填“共价”或“离子”)
(2)元素①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式__________________ ;一种离子化合物的化学式_________
(3)④⑤⑥三种元素的离子半径由大到小的顺序是____________(填离子符号)。
(4)⑧和⑨两种元素的最高价氧化物对应的水化物中酸性较弱的是________(填化学式)。
(5)元素③的气态氢化物和元素⑧的气态氢化物更稳定的是___________(填化学式)。
(6)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应水化物反应,其离子方程式为_________________________________________
【答案】![]() 共价 H2O或H2O2 Na2O或Na2O2 O2->Na+>Mg2+ H2SO4 H2S Al(OH)3+OH-= [Al(OH)4]-或Al(OH)3+OH-=AlO2-+2H2O
共价 H2O或H2O2 Na2O或Na2O2 O2->Na+>Mg2+ H2SO4 H2S Al(OH)3+OH-= [Al(OH)4]-或Al(OH)3+OH-=AlO2-+2H2O
【解析】
根据元素在元素周期表中的位置分析元素的种类并书写原子结构示意图;根据元素周期律结合元素周期表的结构分析解答;根据物质的性质书写相关离子方程式。
(1)元素⑦为铝元素,原子序数为13,则原子结构示意图为![]() ;②为碳元素,④为氧元素,两种元素都为非金属元素,组成的化合物是共价化合物;
;②为碳元素,④为氧元素,两种元素都为非金属元素,组成的化合物是共价化合物;
(2)元素①为氢,④为氧,⑤为钠,两两之间可以形成两种类型的化合物,由非金属元素组成的化合物为共价化合物,其化学式为H2O或H2O2;由金属元素钠和非金属元素氧组成的化合物为离子化合物,其化学式为Na2O或Na2O2;
(3)④为氧元素,⑤为钠元素,⑥为镁元素,三种元素的简单离子的核外电子排布相同,核电荷越大,半径越小,所以半径由大到小的顺序是O2->Na+>Mg2+;
(4)⑧为硫,⑨为氯,同周期元素随核电荷数增大非金属性增强,非金属性越强,其最高价氧化物对应的水化物中酸性越强,所以酸性较弱的是H2SO4;
(5)元素③为磷,⑧为硫,同周期元素随核电荷数增大非金属性增强,其气态氢化物稳定性增强,所以气态氢化物更稳定的是H2S;
(6)元素⑤的最高价氧化物对应的水化物为氢氧化钠,元素⑦的最高价氧化物对应水化物为氢氧化铝,氢氧化铝为两性氢氧化物,与氢氧化钠反应生成偏铝酸钠和水,其离子方程式为 Al(OH)3+OH-= [Al(OH)4]-或Al(OH)3+OH-=AlO2-+2H2O。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子能够大量共存且溶液呈无色的是
A.H+、Ag+、Cl-、SO42-B.Mg2+、Al3+、OH-、SO42-
C.K+、Na+、Cl-、CO32-D.NH4+、MnO4-、Na+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
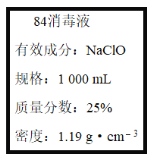
(1)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L-1。
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是____(填字母)。
a.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
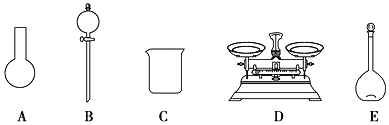
b.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
c.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
d.需要称量NaClO固体的质量为143.0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两种元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M层的电子数之和。
(1)A为________________(填元素名称,下同), C为___________;
(2)写出E的电子式_______________。
(3)A、B的一种化合物与E反应的化学方程式为_______________________;
(4)A、B两种元素形成的化合物属于____________(填“离子”或“共价”)化合物;
(5)D的最高价氧化物对应的水化物的浓溶液和A的单质反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿(FeCr2O4)中含有Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程示意图如下(部分操作和条件略):
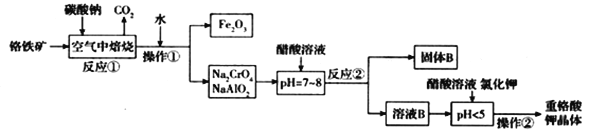
(1)反应①中,焙烧时所用的仪器材质应选用_______(填“瓷质”、“铁质”或“石英质”)。
(2)反应①中发生了两个主要反应,其中一个主要反应的化学方程式为4FeCr2O4 + 8Na2CO3 + 7O2![]() 8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ____________________。
8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ____________________。
(3)加入醋酸溶液,调节溶液的pH < 5时,发生的反应是___________(写离子方程式).
(4)下表是相关物质的溶解度数据:
物质 | 溶解度( g / 100 g H2O ) | ||
0 ℃ | 40 ℃ | 80 ℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
①调节pH < 5后,加入KCl固体经一系列操作析出K2Cr2O7晶体的理由是______________。
②获得K2Cr2O7晶体的操作由多步组成,依次是加入KCl固体、蒸发浓缩、________________、_____________、洗涤、干燥得到晶体。
(5)酸性溶液中过氧化氢能使Cr2O72生成蓝色的CrO5,该反应可用来检验Cr2O72的存在。已知该反应是非氧化还原反应,写出反应的离子方程式:________________,CrO5分子结构中过氧键的数目是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】褪黑素是一种内源性生物钟调节剂,在人体内由食物中的色氨酸转化得到。
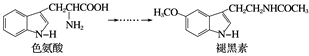
已知色氨酸水溶液中存在平衡:
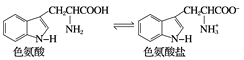
下列说法不正确的是( )
A. 色氨酸分子中存在氨基和羧基,能反应生成盐
B. 在色氨酸水溶液中,可通过调节溶液的pH使其形成晶体析出
C. 在一定条件下,色氨酸可发生脱水缩合反应
D. 褪黑素与色氨酸结构相似,也具有两性化合物的特性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com