
【题目】用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1molCu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为( )
A. 0.4mol B. 0.5mol C. 0.6mol D. 0.8mol
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:
Fe2O3(s)+3CO(s,石墨)═2Fe(s)+3CO2(g)△H1=+489.0kJmol﹣1
C(s,石墨)+CO2(g)═2CO(g)△H2=+172.5kJmol﹣1
则CO还原Fe2O3(s)的热化学方程式为_____。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△H
①取一定体积CO2和H2的混合气体(物质的量之比为1:3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的△H____0(填“>”、“<”或“=”,下同)。
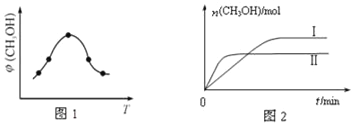
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠ_____KⅡ。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成.开始以氨碳比![]() =3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_____。
=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_____。
②将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10﹣5,碳酸一级电离常数Ka=4.3×10﹣7,则NH4HCO3溶液呈_____(填“酸性”、“中性”或“碱性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是( )
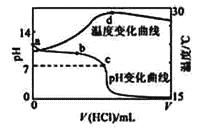
A. a点由水电离出的c(H+)=1.0×10-14mol/L
B. b点:c(NH4+)+c(NH3·H2O) > c(Cl-)
C. c点:反应消耗的HCl 和NH3·H2O 的关系为:n(HCl)= n(NH3·H2O)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之.”文中涉及的操作方法是( )
A.蒸馏
B.升华
C.干馏
D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学与生活的说法错误的是( )
A.铁粉、生石灰均可作食品抗氧化剂
B.明矾、氯化铁均可作净水剂
C.牛奶、鸡蛋清均可用于重金属中毒解毒
D.碘酒、双氧水均可用于伤口消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的含氧酸.实验室用浓硫酸与乙二酸(H2C2O4)晶体加热,可获得CO与CO2的混合气体,再将混合气体进一步通过(填一种试剂的名称)即可得纯净干燥的CO.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A~I之间的转化关系如图所示:
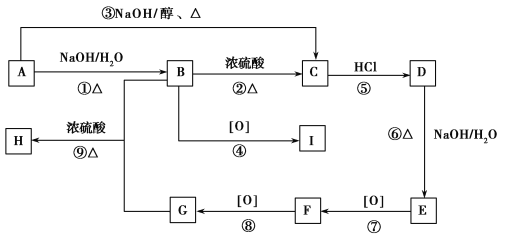
①A与D、B与E、I与F互为同分异构体;
②C的最简式与乙炔相同,且相对分子质量为104;
③A~I均为芳香族化合物。
根据以上信息,回答下列问题:
(1)G中含有的官能团名称为________________。
(2)H的结构简式________________。
(3)I与F互为同分异构体,下列能够鉴别两者的方法或试剂是________。
A.李比希法 B.质谱法 C.红外光谱法 D.核磁共振氢谱法 E.银氨溶液
(4)写出反应⑥的化学方程式:_______________________________。
(5)写出E→F反应的化学方程式:____________________________。
(6)苯环上含有两个取代基且能与NaOH溶液反应,但不与FeCl3溶液发生显色反应的G的同分异构体有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程中,ΔS<0的是
A. 氯化钠溶于水中 B. NH3(g)与HCl(g)反应生成NH4Cl(s)
C. 汽油的燃烧 D. 煅烧石灰石得到生石灰和二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
![]()
![]()
![]()
![]()
![]()
①NH4CuSO3中金属阳离子的核外电子排布式为__________________。N、O、S三种元素的第一电离能大小顺序为____________________(填元素符号)。
②向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是________。
A.氨气极易溶于水,原因之一是NH3分子和H2O分子之间形成氢键的缘故
B.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
C.[Cu(NH3)4]SO4溶液中加入乙醇,会析出深蓝色的晶体
D.已知3.4 g氨气在氧气中完全燃烧生成无污染的气体,并放出a kJ热量,则NH3的燃烧热的热化学方程式为:NH3(g)+3/4O2(g)===1/2N2(g)+3/2H2O(g) ΔH=-5a kJ·mol-1
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的氧气变为臭氧(与SO2互为等电子体)。根据等电子体原理,O3分子的空间构型为________。
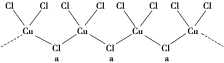
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子(含有一个配位键)的杂化轨道类型为_______________________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,已知镧镍合金与上述Ca-D合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________(保留两位有效数字)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com