
����Ŀ��ͭ���ʼ��仯�����ںܶ������ж�����Ҫ����;����ش��������⣺
(1)��ϸͭ�ۿ�����������ϡ������������Ʊ��������£�
![]()
![]()
![]()
![]()
![]()
��NH4CuSO3�н��������ӵĺ�������Ų�ʽΪ__________________��N��O��S����Ԫ�صĵ�һ�����ܴ�С˳��Ϊ____________________(��Ԫ�ط���)��
����CuSO4��Һ�м��������ˮ��������[Cu(NH3)4]SO4������˵����ȷ����________��
A��������������ˮ��ԭ��֮һ��NH3���Ӻ�H2O����֮���γ������Ե��
B��NH3���Ӻ�H2O���������ӿռ乹�Ͳ�ͬ���������ӵļ���С��ˮ���ӵļ���
C��[Cu(NH3)4]SO4��Һ�м����Ҵ�������������ɫ�ľ���
D����֪3.4 g��������������ȫȼ����������Ⱦ�����������ų�a kJ��������NH3��ȼ���ȵ��Ȼ�ѧ����ʽΪ��NH3(g)��3/4O2(g)===1/2N2(g)��3/2H2O(g) ��H����5a kJ��mol��1
(2)ͭ��������(CuMn2O4)���ڳ����´����������е�������Ϊ����(��SO2��Ϊ�ȵ�����)�����ݵȵ�����ԭ����O3���ӵĿռ乹��Ϊ________��
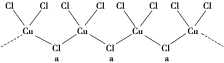
(3)�Ⱥͼ��벻ͬ��̬��ͭ���������ֻ��������������Ӿ�Ϊ�������ṹ(��ͼ��ʾ)��aλ����Clԭ��(����һ����λ��)���ӻ���������Ϊ_______________________��
(4)��ͼ�ǽ���Ca��D���γɵ�ij�ֺϽ�ľ����ṹʾ��ͼ����֪�����Ͻ�������Ca��D�Ͻ�����ͬ���͵ľ����ṹXYn�������к�ǿ�Ĵ�����������֪�����Ͻ�LaNin�������Ϊ9.0��10��23 cm3��������γ�LaNinH4.5�Ͻ�(����뾧����϶���������)����LaNin��n��________(����ֵ)�����ںϽ��е��ܶ�Ϊ________(������λ��Ч����)��

���𰸡�(1)��1s22s22p63s23p63d10(��[Ar]3d10) N��O��S
��AC (2)V�� (3)sp3�ӻ� (4)5 0.083 g��cm��3
��������(1)��NH4CuSO3�еĽ���ͭ���ӵĻ��ϼ�Ϊ��1�������������Ų�ʽΪ��1s22s22p63s23p63d10��[Ar]3d10��һ����������ǽ�����Խǿ�����һ������Խ�����ڵ�ԭ�ӵ�2p����ϵ��Ӵ��ڰ����״̬���ȶ���ǿ���������һ�����ܴ�����Ԫ�أ��������һ�����ܵĴ�С˳����N��O��S��
��A��������֮���γ�������������ӷ��������֮���������������NH3���Ӻ�H2O����֮�����γ��������������������ˮ����ȷ��B����NH3���ӿռ乹�ͳ���������H2O���ӿռ乹��ΪV����NH3������Nԭ����һ�Թµ��Ӷ���H2O��Oԭ�������Թµ��Ӷ����µ��Ӷ���Խ��Գɼ����ӶԵij���Խ������NH3�ļ��Ǵ���ˮ���ӵļ���������C����[Cu(NH3)4]SO4���������������л��ܼ�����ȷ��D������ȼ���ȵ��Ȼ�ѧ����ʽ��ˮӦΪҺ̬������
(2)��Ϊ�ȵ�����ķ��Ӿ�����ͬ�Ŀռ�ṹ��SO2���ӵĿռ乹��ΪV��������O3���ӵĿռ乹��ҲΪV�Ρ�
(3)aλ����Clԭ���γ�2������������2�Թµ��Ӷ����ӻ������Ϊ4�����ӻ�������sp3�ӻ���
(4)��CaDn�����ṹ��֪��8��Caԭ��λ�ھ����Ķ�����Dԭ����8�����ھ���������1���������ġ�����1�������������е�Caԭ����Ϊ��8��![]() ��1�����е�Dԭ����Ϊ8��
��1�����е�Dԭ����Ϊ8��![]() ��1��5����n��5����LaNin��nҲ����5�����ںϽ��е��ܶ�Ϊ������
��1��5����n��5����LaNin��nҲ����5�����ںϽ��е��ܶ�Ϊ������![]() ��0.083 g��cm��3��
��0.083 g��cm��3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ö��Ե缫���һ��Ũ�ȵ�����ͭ��Һ��ͨ��һ��ʱ��������õ���Һ�м���0.1molCu2(OH)2CO3��ǡ�ûָ������ǰ��Ũ�Ⱥ�pH(������CO2���ܽ�)����������й�ת�Ƶ��ӵ����ʵ���Ϊ( )
A. 0.4mol B. 0.5mol C. 0.6mol D. 0.8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��A��B��C��D��AԪ�ص�ԭ�����������Ų�ʽΪms1��BԪ�ص�ԭ�Ӽ۵����Ų�ʽΪns2np2��CԪ��λ�ڵڶ�������ԭ����p�ܼ�������s�ܼ��������������DԪ��ԭ�ӵ�L���p�ܼ�����3��δ�ɶԵ��ӡ�
(1)CԪ��ԭ�ӻ�̬ʱ�ļ۵����Ų�ʽΪ________����AԪ��Ϊ�ǽ���Ԫ����A��C�γɵĻ������еĹ��ۼ�����________��(��ҡ��С�)��
(2)��n��2ʱ��B�������̬�⻯��ķ��ӹ���Ϊ________������ԭ�ӵ��ӻ���ʽΪ________��BC2����________����(����ԡ��Ǽ��ԡ�)����n��3ʱ��B��C�γɵľ�������________���塣
(3)��AԪ�ص�ԭ�����������Ų�ʽΪ2s1��BԪ�ص�ԭ�Ӽ۵����Ų�ʽΪ3s23p2��A��B��C��D����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ____________________(��Ԫ�ط���)��
(4)��ͼΪCԪ�����ѡ���Ԫ���γɵ�ij����ṹ�е���С�ظ���Ԫ���þ�����ÿ����ԭ����Χ��������Ҿ�����ȵĸ�������________�����þ���Ļ�ѧʽΪ________________________��
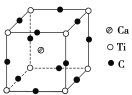
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������㶨���ܱ������з������淴Ӧ��2SO2 (g)+ O2(g) ![]() 2SO3(g)���������������жϸ÷�Ӧ�ﵽƽ��״̬����
2SO3(g)���������������жϸ÷�Ӧ�ﵽƽ��״̬����
A. ������ѹǿ���ٱ仯 B. SO2������������ٱ仯
C. �����л������ܶȲ��ٱ仯 D. �����и����ʵ�Ũ�Ȳ��ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Se)��һ���п��������������õ�Ԫ��,�����γɶ��ֻ����
(1)��̬��ԭ�ӵļ۲�����Ų�ʽΪ____________��
(2)�ࡢ�顢���ĵ�һ�����ܴ�С����Ϊ____________��
H2SeO4�����Ա�H2SeO3��ǿ,��ԭ����____________��
(3)H2SeO3������ԭ���ӻ�������____________;Se![]() �����幹����____________����Se
�����幹����____________����Se![]() ��Ϊ�ȵ�����ķ�����(дһ�����ʵĻ�ѧʽ����)
��Ϊ�ȵ�����ķ�����(дһ�����ʵĻ�ѧʽ����)
_ ___________��
(4)H2Se����________(����ԡ��Ǽ��ԡ�)����;���������۵�Ϊ217��,������________���塣
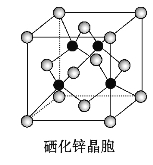
(5)����п��һ����Ҫ�İ뵼�����,�侧���ṹ��ͼ��ʾ,�þ�������ԭ�ӵ���λ��Ϊ___________;
���þ����ܶ�Ϊ��g��cm-3,����п��Ħ������ΪMg��mol-1��NA���������ӵ�����,������aΪ______________pm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�����������+3�����Ļ�������ǣ� ��
�����ۺ�ϡ����ڹ�������ϡ����۹�������FeCl3����ˮ��FeCl2��FeO��ϡ��������ۺ�����ϡ���� ����ƬͶ��CuSO4��Һ������Cl2��ȼ�գ�
A.�ڢۢܢ�
B.�ܢݢޢ�
C.�ۢܢޢ�
D.�ڢۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦSO2��2H2S��2H2O��3S�������������뻹ԭ�����������Ϊ
A��1��1 B��2��1 C��3��1 D��1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Һ���ܴ���������ǣ�������
A.Fe3+��NH4+��SCN����Cl��
B.Na+��Mg2+��NO3����SO42��
C.Al3+��Fe2+��NO3����Cl��
D.K+��Na+��Cl����SiO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯��������������������ϢϢ��ء��ش��������⣺
(1)��̬��ԭ���е�����2p����ϵ��Ų���ѭ��ԭ����______________��ǰ4����Ԫ����,��̬ԭ�Ӻ�������Ų��ɵ�����������Ԫ�صļ۲�����Ų�ʽΪ____________��
(2)C��N��O����Ԫ�ص�һ�����ܴӴ�С��˳����_______________��
(3)N2F2�����е�ԭ�ӵ��ӻ���ʽ��____________,
1 mol N2F2����___________mol�Ҽ���
(4)NF3�ļ���____________NH3�ļ���(�<����>����=��),ԭ����____________��
(5)NH4BF4(�������)�Ǻϳɵ��������ܵ�ԭ��֮һ��1 mol NH4BF4����________mol��λ����
(6)��ȫ���ҵ����ԭ��Ϊ6NaN3+Fe2O3![]() 3Na2O+2Fe+9N2����
3Na2O+2Fe+9N2����
���ȵ������ԭ����ԭ��������ͬ,�۵���������ͬ�ķ��ӻ����Ӿ������ƵĻ�ѧ������,����������������ʡ�д��������![]() ��Ϊ�ȵ�����ķ��ӻ�����____________;
��Ϊ�ȵ�����ķ��ӻ�����____________;
��Na2O�ľ����ṹ��ͼ��ʾ,�����߳�Ϊ566 pm,�����������ӵ���λ��Ϊ____________,Na2O������ܶ�Ϊ________g��cm-3(ֻҪ������ʽ,���ؼ�������)��
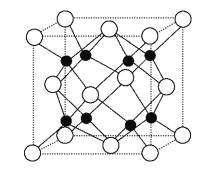
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com