
【题目】硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布式为____________。
(2)锗、砷、硒的第一电离能大小排序为____________。
H2SeO4的酸性比H2SeO3的强,其原因是____________。
(3)H2SeO3的中心原子杂化类型是____________;Se![]() 的立体构型是____________。与Se
的立体构型是____________。与Se![]() 互为等电子体的分子有(写一种物质的化学式即可)
互为等电子体的分子有(写一种物质的化学式即可)
_ ___________。
(4)H2Se属于________(填“极性”或“非极性”)分子;单质硒的熔点为217℃,它属于________晶体。
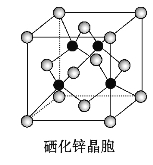
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为___________;
若该晶胞密度为ρg·cm-3,硒化锌的摩尔质量为Mg·mol-1。NA代表阿伏加德罗常数,则晶胞参数a为______________pm。
【答案】(1)4s24p4
(2)As>Se>Ge H2SeO4分子中非羟基氧数大于H2SeO3
(3)sp3 三角锥形 CCl4(或SiF4)
(4)极性 分子 (5)4 ![]() ×1010
×1010
【解析】(1)硒的质子数为16+18=34,基态硒原子的电子排布式为1s22s22p63s23p63d104s24p4,故硒原子价层电子排布式为4s24p4。
(2)砷原子的4p轨道达到半充满状态,故砷的第一电离能大于硒。硒酸分子中有2个非羟基氧,亚硒酸分子中有1个非羟基氧,非羟基氧越多,硒元素的价态越高,导致氢氧键上电子向氧原子偏移程度增大,电离氢离子能力增强,故硒酸的酸性比亚硒酸的强。
(3)H2SeO3中硒原子价层电子对数为![]() =4,中心原子的杂化类型为sp3杂化。Se
=4,中心原子的杂化类型为sp3杂化。Se![]() 的硒原子价层电子对数为4,其中,一个孤电子对、三个成键电子对,立体构型为三角锥形;Se
的硒原子价层电子对数为4,其中,一个孤电子对、三个成键电子对,立体构型为三角锥形;Se![]() 的等电子体有CCl4、SiCl4、SiF4、CBr4等。
的等电子体有CCl4、SiCl4、SiF4、CBr4等。
(4)硒化氢类似水分子,V形结构,它是极性分子。根据硒单质的熔点可判断其为分子晶体。
(5)观察图示知,该晶胞中含4个锌离子,4个硒离子,故硒化锌的化学式为ZnSe。硒或锌的配位数为4,由密度公式知,ρ=![]() ,单位换算:1 m=100 cm=109nm=1012pm。
,单位换算:1 m=100 cm=109nm=1012pm。


科目:高中化学 来源: 题型:
【题目】下列有关化学与生活的说法错误的是( )
A.铁粉、生石灰均可作食品抗氧化剂
B.明矾、氯化铁均可作净水剂
C.牛奶、鸡蛋清均可用于重金属中毒解毒
D.碘酒、双氧水均可用于伤口消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学习的电化学知识,下列说法正确的是
A. 太阳能电池的主要材料为二氧化硅
B. 铁与电源正极连接可实现电化学保护
C. 酸雨后钢铁易发生析氢腐蚀、铁锅存留盐液时易发生吸氧腐蚀
D. iPhone7s用的锂离子电池属于一次电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在“天宫二号”上蚕宝宝的“太空屋”形似胶囊(如图),两端的半球体由航天铝合金打造,中间部分采用透明有机玻璃,蚕宝宝由聚氨酯海绵包裹着。

①蚕丝的主要成份为________(填字母)。
a. 多糖 b. 蛋白质 c. 油脂
②有机玻璃和聚氨酯海绵均属于________(填字母)。
a. 金属材料 b. 无机非金属材料 c. 有机高分子材料
③钛铝合金是常见的航天铝合金,下列不属于钛铝合金性质的是________(填字母)。
a. 高密度 b. 高强度 c. 高韧性
品名:果肉果冻
配料表:水、白砂糖、桔子
果肉(≥15%)、魔芋粉。
食品添加剂:卡拉胶、黄原
胶、柠檬酸、氯化钾、桔子
香精、甜密素、柠檬黄、诱
惑红、山梨酸钾
(2)某品牌果冻标签如图所示。回答下列问题:
①食品添加剂中,属于无机盐的是________(填化学式)。
②属于着色剂的是诱惑红和________;属于防腐剂的是________。
③配料表中白砂糖的成分是蔗糖,请写出蔗糖在人体内水解的化学方程式__________________。
(3)化学与科学技术、生产生活及环境保护等密切相关。
①2016年12月我省启动了保卫碧水蓝天的“263”行动,减少煤炭消费总量,减少雾霾天气的发生。形成硫酸型酸雨的主要气体是________;严格整治畜禽养殖场污染,主要是为减少________和P等元素及化学需氧量对水体的污染。
②目前正在推广用尿素水解液来消除柴油汽车尾气中的氮氧化物。写出尿素水解液中的NH3与NO在催化剂作用下,反应生成无污染物质的化学方程式_________________。
③阿司匹林作为一种药物,主要具有________作用;Mg2Si3O8·nH2O(三硅酸镁)具有治疗胃酸过多的作用,写出其与胃酸反应生成SiO2·H2O等物质的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去括号内的杂质,所选用的试剂或方法正确的是
A. Na2CO3溶液(NaHCO3),加适量的Ca(OH)2溶液,过滤
B.Mg (Al),加过量的NaOH溶液,过滤
C.FeCl3溶液(CuCl2),加入过量的Fe粉,过滤
D.NaHCO3溶液(Na2CO3),加适量的CaCl2溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
![]()
![]()
![]()
![]()
![]()
①NH4CuSO3中金属阳离子的核外电子排布式为__________________。N、O、S三种元素的第一电离能大小顺序为____________________(填元素符号)。
②向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是________。
A.氨气极易溶于水,原因之一是NH3分子和H2O分子之间形成氢键的缘故
B.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
C.[Cu(NH3)4]SO4溶液中加入乙醇,会析出深蓝色的晶体
D.已知3.4 g氨气在氧气中完全燃烧生成无污染的气体,并放出a kJ热量,则NH3的燃烧热的热化学方程式为:NH3(g)+3/4O2(g)===1/2N2(g)+3/2H2O(g) ΔH=-5a kJ·mol-1
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的氧气变为臭氧(与SO2互为等电子体)。根据等电子体原理,O3分子的空间构型为________。
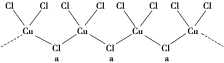
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子(含有一个配位键)的杂化轨道类型为_______________________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,已知镧镍合金与上述Ca-D合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________(保留两位有效数字)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种气态烃,标况下的密度为1.25g/L,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
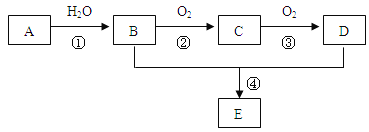
(1)写出A的结构简式 。
(2)B、D分子中所含官能团的名称分别是 、 。
(3)物质B可以直接氧化为D,需要加入的试剂是 。
(4)写出下列反应的化学方程式:
反应②的化学方程式: 。反应类型: ;
反应④的化学方程式: 。反应类型: ;
(5)B可由含淀粉的浓产品如玉米、小麦、薯类等经发酵、蒸馏而得。请写出淀粉水解的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的由Cu和Cu2O组成的混合粉末加入到125 mL 2.6 mol·L-1的硝酸中,固体恰好完全溶解,得蓝色溶液X并收集到V mL(标准状况)的纯净无色气体Y。下列结论正确的是( )
A. X中有两种溶质
B. Y通入纯水中得到酸性溶液
C. 原混合粉末的总质量小于7.8 g
D. 当V=1 680时,原混合粉末中Cu和Cu2O的物质的量之比为8∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图实验装置验证通过改变浓度来实现反应,2Fe3++2I-=2Fe2++I2中Fe3+与Fe2+的相互转化。K 闭合时,电流表指针第一次发生偏转,当指针归零后,向左管滴油加0.01mol/L的AgNO3溶液,发现指针第二次偏转,方向相反。下列有关说法不正确的是( )
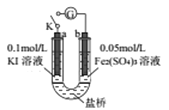
A. 指针第一次偏转时,b极反应式为Fe3++e-=Fe2+
B. 加入AgNO3后,a为正极
C. 当b极有0.001molFe3+被还原时,则通过盐桥的电子数为0.001NA
D. 第二次指针偏转的原因是:I-浓度减小,反应逆向进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com