

| 1 |
| 1.6 |
| 1 |
| 1.6 |
| 1 |
| 1.6 |


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
| A、c(H+)/c(OH-)=1012的溶液中:NH4+、K+、HCO3-、NO3- |
| B、c(OH-)=0.1mol/L的溶液中:CO32-、Cl-、F-、K+ |
| C、含大量Al3+的溶液中:K+、Na+、SO32-、ClO- |
| D、甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室有一包KCl和AlCl3的固体混合物,通过以下实验可确定KCl和AlCl3的质量之比,试根据实验方法和主要步骤,回答有关问题:
实验室有一包KCl和AlCl3的固体混合物,通过以下实验可确定KCl和AlCl3的质量之比,试根据实验方法和主要步骤,回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
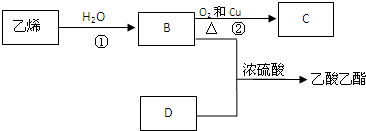
查看答案和解析>>
科目:高中化学 来源: 题型:
A、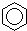 +HNO3 +HNO3
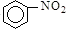 +H2O;取代反应 +H2O;取代反应 | |||
| B、CH2=CH2+Br2→CH2Br-CH2Br;加成反应 | |||
C、CH4+Cl2
| |||
D、CH3CH2OH+CH3COOH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 某烃X,其比例模型中碳原子连接方式如图所示(氢原子均省略),下列说法正确的是( )
某烃X,其比例模型中碳原子连接方式如图所示(氢原子均省略),下列说法正确的是( )| A、X的分子式C3H6 |
| B、完全燃烧时消耗氧气的体积是自身体积(相同条件)的4倍 |
| C、X与足量氯化氢发生加成反应时最多可得到两种产物 |
| D、无法确定X的分子式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com