
【题目】普鲁卡因M(结构简式为![]() )可用作临床麻醉剂,熔点约60 ℃。它的一条合成路线如下图所示(部分反应试剂和条件已省略):
)可用作临床麻醉剂,熔点约60 ℃。它的一条合成路线如下图所示(部分反应试剂和条件已省略):
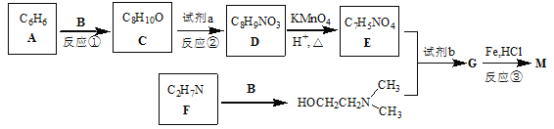
已知:B和乙醛互为同分异构体;![]() 的结构不稳定。
的结构不稳定。
完成下列填空:
(1)比A多两个碳原子,且一氯代物只有3种的A的同系物的名称是____________。
(2)写出反应①和反应③的反应类型反应①_______________,反应③_______________。
(3)写出试剂a和试剂b的名称或化学式 试剂a________________,试剂b____________________。
(4)反应②中将试剂a 缓缓滴入C中的理由是_____________________________。
(5)写出B和F的结构简式 B________________________,F________________
(6)写出一种同时满足下列条件的D的同分异构体的结构简式________________。
①能与盐酸反应 ②能与碳酸氢钠反应 ③苯环上有2种不同环境的氢原子
【答案】1,2-二甲苯(或邻二甲苯) 取代反应 还原反应 浓硝酸,浓硫酸 浓硫酸 防止出现多硝基取代的副产物 ![]() (CH3)2NH
(CH3)2NH ![]() (任写一种)
(任写一种)
【解析】
B和乙醛互为同分异构体,且![]() 的结构不稳定,则B为
的结构不稳定,则B为![]() ,由F与B反应产物结构可知,C2H7N的结构简式为H3C﹣NH﹣CH3。由普鲁卡因M的结构简式(
,由F与B反应产物结构可知,C2H7N的结构简式为H3C﹣NH﹣CH3。由普鲁卡因M的结构简式(![]() ),可知C6H6的结构简式为
),可知C6H6的结构简式为![]() ,与环氧乙烷发生类似加成反应得到C为
,与环氧乙烷发生类似加成反应得到C为![]() ,对比C、D分子式可知,C发生硝化反应得到D,由普鲁卡因M的结构可知发生对位取代反应,故D为
,对比C、D分子式可知,C发生硝化反应得到D,由普鲁卡因M的结构可知发生对位取代反应,故D为![]() ,D发生氧化反应得到E为
,D发生氧化反应得到E为![]() ,E与HOCH2CH2N(CH3)2发生酯化反应得到G为
,E与HOCH2CH2N(CH3)2发生酯化反应得到G为![]() ,G中硝基被还原为氨基得到普鲁卡因,据此解答。
,G中硝基被还原为氨基得到普鲁卡因,据此解答。
(1)比A多两个碳原子,且一氯代物只有3种的A的同系物为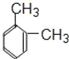 ,名称是1,2﹣二甲苯,故答案为1,2﹣二甲苯;
,名称是1,2﹣二甲苯,故答案为1,2﹣二甲苯;
(2)反应①属于取代反应,反应③属于还原反应,故答案为取代反应;还原反应;
(3)反应②为硝化反应,试剂a为浓硝酸、浓硫酸,反应③为酯化反应,试剂b为浓硫酸,故答案为浓硝酸、浓硫酸;浓硫酸;
(4)反应②中将试剂a缓缓滴入C中的理由是:防止出现多硝基取代的副产物,故答案为防止出现多硝基取代的副产物;
(5)B的结构简式为![]() ,F的结构简式:H3C﹣NH﹣CH3,故答案为
,F的结构简式:H3C﹣NH﹣CH3,故答案为![]() ;H3C﹣NH﹣CH3;
;H3C﹣NH﹣CH3;
(6)一种同时满足下列条件的D(![]() )的同分异构体:①能与盐酸反应,含有氨基,②能与碳酸氢钠反应,含有羧基,③苯环上有2种不同环境的氢原子,可以是含有2个不同的取代基处于对位,符合条件的同分异构体为
)的同分异构体:①能与盐酸反应,含有氨基,②能与碳酸氢钠反应,含有羧基,③苯环上有2种不同环境的氢原子,可以是含有2个不同的取代基处于对位,符合条件的同分异构体为![]() 等,故答案为
等,故答案为![]() 。
。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】化学与人类生活、社会可持续发展密切相关,下列说法中不正确的是
A.2020年北京冬奥会速滑服主要材料是聚氨酯,属于有机高分子化合物
B.用CO2生产可降解塑料![]() ,原子利用率100%,符合绿色化学原则
,原子利用率100%,符合绿色化学原则
C.生活中菜叶、鱼骨等垃圾可以作为沼气原料,沼气属于不可再生能源
D.我国成功研制世界最大口径单体碳化硅反射镜,碳化硅属于无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是( )
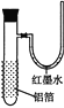
A.铝与硝酸汞反应属放热反应
B.铝是一种较活泼的金属,
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
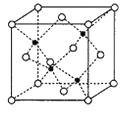
【题目】(化学选3——物质结构与性质)利用 合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
(1)Mn2+的核外电子排布式为:________________,其单电子数为_________________。
(2)C、N、O、Mn电负性由大到小的顺序是___________。
(3)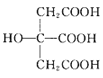 也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
(4)蓝色物质KFe(Ⅲ)x[Fe(Ⅱ)(CN)6]可缓解重金属中毒,x=_______;该物质中不存在的作用力有_____。
A.范德华力 B.离子键 C.σ键 D.π键 E.氢键
(5)副族元素钴的氧化物可以在室温下完全氧化甲醛(HCHO)。甲醛分子的立体构型为_____;甲醛常温下为气体而甲醇(CH3OH)为液体的原因是________________________________ 。
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图所示,其中(○为Se,![]() 为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠是一种淡黄色固体,有漂白性,能与水、酸性氧化物和酸反应。
(1)一定条件下,m克的H2、CO的混合气体在足量的氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重___克。
(2)常温下,将14.0克的Na2O和Na2O2的混合物放入水中,得到400mLpH=14的溶液,则产生的气体标准状况下体积为___L。
(3)在200mLAl2(SO4)3和MgSO4的混合液中,加入一定量的Na2O2充分反应,至沉淀质量不再减少时,测得沉淀质量为5.8克。此时生成标准状况下气体体积为5.6L。则原混合液中c(SO42-)=___mol/L。
(4)取17.88gNaHCO3和Na2O2的固体混合物,在密闭容器中加热到250℃,经充分反应后排出气体,冷却后称得固体质量为15.92g。请列式计算:
①求原混合物中Na2O2的质量B___;
②若要将反应后的固体反应完,需要1mol/L盐酸的体积为多少毫升___?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,对于0.10molL﹣1的氨水,下列判断正确的是
A.与AlCl3溶液反应发生的离子方程式为 Al3++3OH﹣═Al(OH)3↓
B.用HNO3溶液完全中和后,溶液不显中性
C.加水稀释后,溶液中c(NH4+)c(OH﹣)变大
D.1L0.1molL﹣1的氨水中有6.02×1022个NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
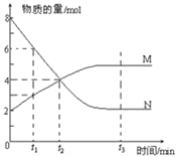
(1)该反应的化学方程式是_____________________________
(2)在图上所示的三个时刻中___________(填t1、t2或t3)时刻处于平衡状态,此时v正________v逆(填>、<或=);达到平衡状态后,平均反应速率v(N):v(M)=___________
(3)若反应容器的容积不变,则“压强不再改变”_________(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是________(选填字母) A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
(5)向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应:2SO2(g)+O22SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,则以O2表示的反应速率为________;平衡时SO3的物质的量浓度________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是
A. c(H+)/c(NH4+) B. c(NH3·H2O)/ c(OH-)
C. c(NH4+) c(OH-)/c(NH3·H2O) D. c(H+)c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。

请回答下列问题:
(1)上述流程脱硫实现了______________(选填下列字母编号);
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是___________________;
(3)已知: 25℃、101kpa时,
①Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
②S(s)+O2(g)=SO2(g) △H=-297kJ/mol
③Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是_________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是______。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是________。
(6)KMnO4溶液与MnSO4溶液反应的离子反应方程式是________。
(7)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2_________kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com