
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)=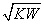 mol·L-1
mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
氯化铜 (CuCl2·2H2O)中含FeCl2杂质。为制得纯净氯化铜晶体,首先将其制成水溶液, 然后按下面所示操作步骤进行提纯。
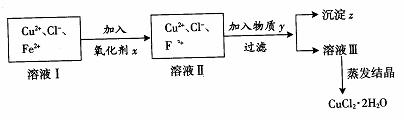
(1)加入氧化剂x的目的是
(2)下列氧化剂中最适合本实验的是
A.Cl2 B.KMnO4 C.NaClO D.H2SO4
(3)物质y和沉淀z的化学式分别是 和
查看答案和解析>>
科目:高中化学 来源: 题型:
现有pH=5的CH3COOH溶液10 mL,要使其pH增大3,可采取的方法有
A.向溶液中加水稀释至10 L
B.加入一定量的NaOH固体
C.加入一定量pH=8的NaOH溶液
D.加入一定浓度的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为对10 mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图像,依据图像推出X和Y的物质 的量浓度是下表内各组中的
的量浓度是下表内各组中的
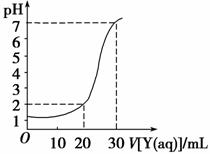
| A | B | C | D | |
| X/mol·L-1 | 0.12 | 0.04 | 0.03 | 0.09 |
| Y/mol·L-1 | 0.04 | 0.12 | 0.09 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:

根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为________________________________。
(2)混合①中使用冰水的目的是________________________________。
(3)操作Ⅱ和操作Ⅲ的名称分别是________、________。
操作Ⅲ一般适用于分离________混合物。(选填编号)
a.固体和液体 b.固体和固体
c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色,于是甲乙丙同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为________,若假设成立,可观察到的现象为________。乙同学假设工业氢溴酸呈淡黄色是因为________,其用于证明该假设所用的试剂为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是____________________________________________
________________________________________________________________________
(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH )________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
)________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH )。
)。
(3)如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。

①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填写字母),导致pH随温度变化的原因是__________________________________________________________;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO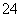 )-c(NH
)-c(NH )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com