
将浓度为0.1 mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+) B.Ka(HF)
C.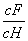 D.
D.
科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3; ③1s22s22p3; ④1s22s22p5。则下列有关比较中正确的是
A.第一电离能:①>② B.原子半径:④>③
C.电负性: ②>③ D.氢化物稳定性:①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
下列共有十二种化学符号:
①O2 ②614C ③238U ④1123Na ⑤O3 ⑥714N ⑦1224Mg ⑧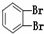
⑨235U ⑩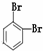 (11)
(11)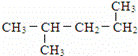 (12)
(12)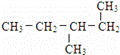
其中:
(1)表示核素的符号共有___种.
(2)互为同位素的是___(填序号,以下相同).
(3)质量数相等,但不能互称同位素的是___.
(4)中子数相等,但质子数不相等的是___.
(5)互为同素异形体的是___.
(6)互为同分异构体的是___.
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,对于反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
2NH3(g) ΔH=-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是

A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量 为92.4 kJ
为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增 大压强,H2的转化率增大
大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇可通过将煤气化过程中生成的CO和H2在一定条件下,发生如下反应制得:CO(g)+2H2(g)  CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________,CO的转化率为________。
(2)该反应的平衡常数表达式为________________,温度升高,平衡常数________(填“增大”、“减小”或“不变”)。
(3)若在一体积可变的密闭容器中充入1 mol CO、2 mol H2和1 mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则加入各物质后该反应向________(填“正”或“逆”)反应方向移动,理由是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.1 mol·L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时都会引起
A.CH3COOH电离程度变大
B.溶液pH减小
C.溶液的导电能力减弱
D.溶液中c(H+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定体积的NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液的体积为V2;则下列叙述正确的是
A.若V1>V2,则说明HA的酸性比HB的酸性强
B.若V1>V2,则说明HA的酸性比HB的酸性弱
C.因为两种酸溶液的pH相等,故V1一定等于V2
D.HA、HB分别和NaOH中和后,所得的溶液都一定呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)=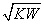 mol·L-1
mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com