
| A.Fe2+和S2O32—都是还原剂 |
| B.x=6 |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol |
| D.每生成1mol Fe3O4,反应转移的电子总数为3mol |
 mol,C不正确;D、反应3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,反应转移的电子总数为4mol,故D不正确,答案选A。
mol,C不正确;D、反应3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,反应转移的电子总数为4mol,故D不正确,答案选A。

科目:高中化学 来源:不详 题型:填空题
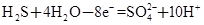 ②
②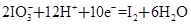
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.O3在反应中被氧化为O2 | B.1molO3在反应中得到6mol电子 |
| C.KI在反应中被还原为I2 | D.KI在反应中被氧化为I2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 序号 | 实验设计 | 实验观察(主要现象) | 离子方程式 | 解释与结论 |
| ① | 在铁粉中滴 入稀硫酸 | 铁粉溶解,溶液由无 色变成浅绿色,有无 色无味的的气体生成 | Fe +2H+= H2↑+ Fe2+ | Fe具有还原性 |
| ② | 氯化亚铁溶液中滴入KSCN溶液,再加入氯水 | 滴入KSCN溶液无明 显变化,加入氯水立 即变成血红色 | | |
| ③ | 氯化亚铁溶液加 入锌片 | | Fe2++ Zn =" Fe" + Zn 2++ | |
| ④ | | | | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应中硫元素被氧化,所有铁元素均被还原 |
| B.氧化剂是Fe3+,氧化产物是Cu2+ |
| C.反应中转移电子的物质的量为x mol |
| D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x) mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该反应的氧化产物仅为S |
| B.生成1molH3AsO2时。转移电子个数为10NA |
| C.将反应设计成一原电池,则NO2应该在正极附近逸出 |
| D.反应产生的NO2与56LO2混合在水中正好完全反应生成硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com