
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
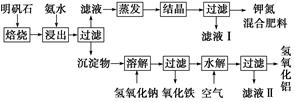
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500 mL稀氨水(每升含有39.20 g氨)需要取浓氨水(每升含有251.28 g氨)__________mL,用规格为__________mL量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、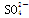 外,还有大量的
外,还有大量的 。检验
。检验 的方法是________________________________________________________________________
的方法是________________________________________________________________________
________________________________________________________________________。
(3)写出沉淀物中所有物质的化学式________________________________________________________________________。
(4)滤液Ⅰ的成分是水和______________________。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量__________溶液,产生白色沉淀。
②__________、__________、__________(依次填写实验操作名称)。
③冷却、称重。
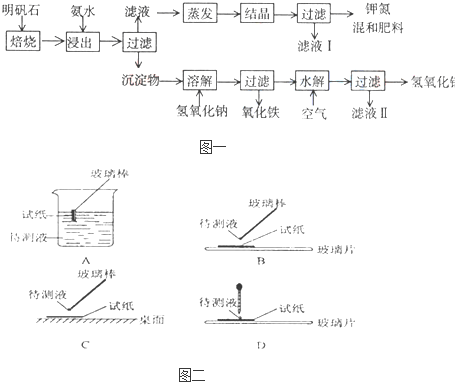
(6)若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为__________mol(用含有m、n的代数式表示)。
(1)78 100
(2)取滤液少许,加入NaOH溶液,加热,生成的气体能使湿润的红色石蕊试纸变蓝
(3)Al(OH)3、Al2O3和Fe2O3 (4)K2SO4、(NH4)2SO4
(5)①BaCl2[或Ba(NO3)2] ②过滤 洗涤 干燥
(6)
【解析】
试题分析:(1)根据稀释前后溶质的质量不变得:0.5 L×39.20 g·L-1=V×251.28 g·L-1,V=0.078 L=78 mL。为了减少误差,最好选用比氨水的实际体积稍大一点的量筒。
(2)NH的检验方法是:先往NH4+中加入强碱,使之转化为NH3,然后检验NH3即可。
(3)Al3++3NH3·H2O===Al(OH)3↓+3NH4+,根据题意,明矾石中含有Al2O3、Fe2O3,所以沉淀物为Al(OH)3、Al2O3和Fe2O3。
(4)由于明矾石的组成与明矾相似,所以滤液的成分中含有K2SO4和反应后生成的(NH4)2SO4以及水。
(5)混合肥料中含有K2SO4和(NH4)2SO4,要产生白色沉淀,加入的溶液为BaCl2或Ba(NO3)2溶液,以后的操作为:先将混合液过滤,然后洗涤,最后干燥,冷却后称量。
(6)根据题意有:174n(K2SO4)+132n[(NH4)2SO4]=m g……①再由SO42-守恒得:n(K2SO4)+n[(NH4)2SO4]=n mol……②,n(K2SO4)= mol。
mol。
考点:考查仪器的选择、离子的检验、物质成分的判断以及物质含量的有关计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。


科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| (m-132n) |
| 42 |
| (m-132n) |
| 42 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:

根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有251.28g氨)__________mL,用规格为_______mL量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是______________________________________________。
(3)写出沉淀物中所有物质的化学式________________________________________。
(4)滤液I的成分是水和______________。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量______溶液,产生白色沉淀。
②___________、__________、_________(依次填写实验操作名称)。
③冷却、称重。
(6)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:___________mol(用含有m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省漳州市七校高三第二次联考化学试卷(解析版) 题型:填空题
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾[KAl(SO4)2?12H2O]相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:

根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500ml稀氨水(每升含有39.00g氨)需要取浓氨水(每升含有250g氨)__________ml,用规格为_______ml量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是_______________________________________________________。
(3)写出沉淀物中所有物质的化学式________________________________________。
(4)滤液的成分是水和______________。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量______溶液,产生白色沉淀。②_______、______、干燥(填实验操作名称)。③冷却、称重。
(6)若试样为mg,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为:______(用含有m、n的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com