
【题目】某微粒A的结构示意图为![]()
(1)若A是原子,则A的元素符号为__;若A是带一个正电荷的阳离子,则X=__。
(2)若X=8,则此阴离子与(1)中带一个正电荷的阳离子形成一种常见化合物的化学式是__,写出此化合物与盐酸反应的化学方程式:__。
(3)1mol微粒A含有10mol电子,下列微粒各1mol,也含有10mol电子的有:__(填序号)。
①CH4 ②H2O2 ③HF ④Al3+ ⑤Cl- ⑥NH4+
(4)若A的阳离子为An+且质量数为a,则中子数为__(用含有a,n的代数式表达)。
【答案】Ne 11 Na2O Na2O+2HCl=2NaCl+H2O ①③④⑥ a-(10+n)或a-10-n
【解析】
(1)在原子中,核内质子数=核外电子数,当x=10时,该微粒是Ne原子;若A是带一个正电荷的阳离子,则核内质子数比核外电子数多1,即为11;
(2)当x=8时,核内质子数小于核外电子数,该粒子是氧离子,与钠离子形成一种常见化合物的化学式是Na2O,与盐酸反应的方程式为:Na2O+2HCl=2NaCl+H2O;
(3)甲烷、氟化氢分子含有10个电子,铝离子、铵根离子含有10个电子;所以选①③④⑥;
(4)A的阳离子为An+且质量数为a,则其质子数为10+n,中子数为质量数-质子数=a-(10+n)。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】美国科学家JohnB.Goodenough荣获2019年诺贝尔化学奖,他指出固态体系锂电池是锂电池未来发展方向。Kumar等人首次研究了固态可充电、安全性能优异的锂空气电池,其结构如图所示。已知单位质量的电极材料放出电能的大小称为电池的比能量。下列说法错误的是( )
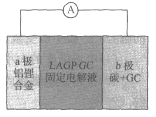
A.a极反应为“Li-e-=Li+,b极发生还原反应
B.充电时,Li+由a极通过固体电解液向b极移动
C.电路中转移4mol电子,大约需要标准状况下112L空气
D.与铅蓄电池相比,该电池的比能量大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式不正确的是
A.次氯酸的电离方程式: HClO![]() H++ClO-
H++ClO-
B.盐酸与小苏打溶液反应的离子方程式: H++HCO![]() =CO2↑+H2O
=CO2↑+H2O
C.工业制备粗硅的化学方程式: SiO2+C ![]() Si+CO2 ↑
Si+CO2 ↑
D.苯和浓硝酸反应的化学方程式: ![]() +HO-NO2
+HO-NO2![]()
![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组同学用如图所示装置进行系列实验,以探究气体的性质(部分仪器已略去)。
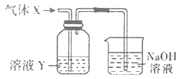
回答下列问题:
(1)若气体X为氯气,溶液Y为含有少量KSCN的FeCl2溶液,则可观察到溶液Y中的实验现象是___,写出NaOH溶液中发生反应的离子方程式:___。
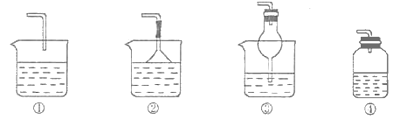
(2)若溶液Y为品红溶液,气体X通过后,溶液褪色。取少量褪色后的溶液加热后恢复为红色,则气体X可能是___(填化学式)。根据气体X的性质,上述实验装置应作一定的改进,则下列装置中可用来替代其尾气吸收装置的是___(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙、丙三个恒容密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。
2C(g)。
相关数据如下表,反应过程中C的浓度随时间变化关系如下图。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0. 5 mol B | 6 mol A 2 mol B |
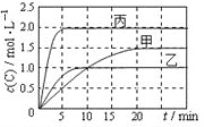
A. T1>T2,x=1
B. T2℃时,该反应的平衡常数为0. 8
C. A的平衡转化率a(甲):a(乙)=2:3
D. 15~20min内C的平均反应速率v(乙)< v(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:
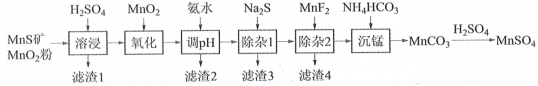
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀![]() pH范围如下:
pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8 3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)写出基态锰原子核外电子排布式___。
(2)“氧化”中添加适量的MnO2发生反应的离子方程式是___。
(3)“调pH”除铁和铝,溶液的pH范围应调节为___~6之间。
(4)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是___。
(5)写出“沉锰”的离子方程式___。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___。
时,z=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将![]() 和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
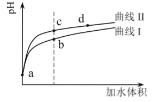
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
D.c点到d点,溶液中![]() 保持不变(HA、A-代表相应的酸和酸根离子)
保持不变(HA、A-代表相应的酸和酸根离子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com