
 ��
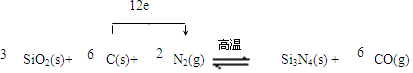
������ ��1�����ݵ������ת�Ƶ���֮��Ĺ�ϵʽ���㣻
��2����������ԭ��Ӧ�У��õ��ӻ��ϼ۽��͵ķ�Ӧ������������ʧ���ӻ��ϼ����ߵķ�Ӧ���ǻ�ԭ����������
��3��������Ӧ�У�ÿ����1mol Si3N4��N2�õ�2mol��2��[0-��-3��]=12mol���ӣ���������0.25mol Si3N4����Ӧ������ת��12��0.25=3mol��
��� �⣺��1��������Ӧ�У�ÿ����1mol Si3N4��N2�õ�2mol��2��[0-��-3��]=12mol���ӣ����Է�Ӧ�е���ת�Ƶ���Ŀ12e-�����Ե���ת�Ƶķ������ĿΪ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2���÷�Ӧ�У������õ��ӣ�̼ʧ���ӣ����������и�Ԫ�صĻ��ϼ۲��䣬���Ե�������������������ԭ��Ӧ��̼�ǻ�ԭ����������������������Ϊ��CO���ʴ�Ϊ��CO��N2��C��
��3��������Ӧ�У�ÿ����1mol Si3N4��N2�õ�2mol��2��[0-��-3��]=12mol���ӣ���������0.5molSi3N4����Ӧ������ת��12��0.5mol=6mol��6NA�����ӣ��ʴ�Ϊ��6NA��
���� ���⿼��������ԭ��Ӧ����ȷԪ�ػ��ϼ��ǽⱾ��ؼ���ע������е�Ԫ�صĻ��ϼۣ�Ϊ�״��㣮


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ʯ��ˮ | B�� | ��ˮ�Ҵ� | C�� | ���� | D�� | һ����̼ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ȼ�ղ�������ʱ��������ˮ����� | |
| B�� | ���Ʊ�����ʯ���ͻ�ú���У��Ը������� | |
| C�� | ��Ͷ������ͭ��Һ�У����ҷ�Ӧ�������ɽ���ͭ | |
| D�� | ����з�̪������ˮ�м����̶���С��һ���ƣ��ɹ۲쵽��Һ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ı�ȼ����Ϊ890.3 kJ•mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=-890.3 kJ•mol-1 | |
| B�� | ��֪2SO2��g��+O2��g��?2SO3��g����H=-196.64kJ•mol-1���������г���1mol SO2��0.5mol O2��ַ�Ӧ���ų�������Ϊ98.32KJ | |
| C�� | ��֪��120C��101kPaʱ��1gH2ȼ������ˮ�����ų�121KJ�����Ȼ�ѧ����ʽ��ʾΪH2��g��+$\frac{1}{2}$O2��g��=2H2O��l����H=-242KJ/mol | |
| D�� | CO��g�� ��ȼ������283.0kJ•mol-1����CO2��g��=CO��g��+$\frac{1}{2}$O2��g����H=+283kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
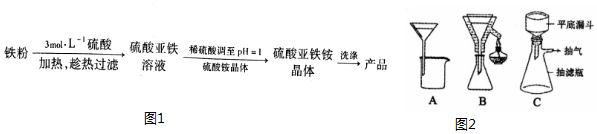
| ���� | 0�� | 10�� | 20�� | 30�� | 40�� | 50�� | 70�� |
| FeSO4•7H2O | 28.8 | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| ��NH4��2SO4 | 70.6 | 73 | 75.4 | 78.0 | 81 | 84.5 | 94.9 |
| ��NH4��2SO4•FeSO4•6H2O | 14.5 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
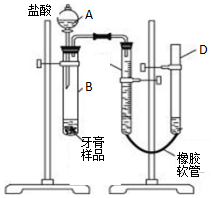 ij�о���ѧϰС���ͬѧ�dz��õ�����Ʒ��������Ħ�����ɷֽ��е��飬��������
ij�о���ѧϰС���ͬѧ�dz��õ�����Ʒ��������Ħ�����ɷֽ��е��飬��������| ijƷ��ҩ������ | ijƷ�ƶ�ͯ���� | ijƷ�������� | |
| Ħ���� | ̼��� | �������� | �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
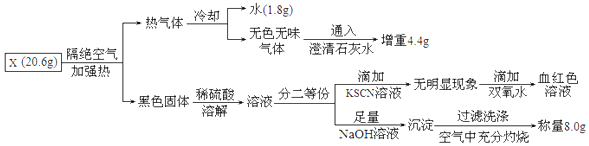
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 9��6��0 | B�� | 4��3��1 | C�� | 3��3��2 | D�� | 7��6��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ʼ��ٵķ�Ӧһ�������Է����� | B�� | �����ӵķ�Ӧ�����Է����� | ||
| C�� | �����ӵķ�Ӧһ�������Է����� | D�� | �ؼ��ٵķ�Ӧһ�������Է����� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com