
| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(A)/mol | 0.4 | 0.8 | 0.8 |
| n(B)/mol | 0.24 | 0.24 | 0.48 | |
| A的平衡转化率 | 80% | α1 | α2 | |
| A. | 甲从开始到平衡时ν(A)为0.032mol•L-1•min-1 | |
| B. | 平衡时,A的转化率:α1<80%<α2 | |
| C. | T℃时,平衡常数K=400L/mol | |
| D. | 绝热容器中,压缩体积,平衡常数K>400 L/mol |
分析 A.平衡时A的转化率为80%,则A的浓度变化量为$\frac{0.4mol×80%}{2L}$=0.16mol/L,再根据v=$\frac{△c}{△t}$计算;
B.乙与甲相比,等效为在甲平衡的基础上加入0.4molA,A的转化率比甲中的小,而丙等效为在甲的基础压强增大一倍,平衡正向移动,A的转化率大于甲中;
C.甲中平衡时,平衡时A的转化率为80%,转化的A为0.4mol×80%=0.32mol,则:
2A(g)+B(g)?2C(g)
起始量(mol):0.4 2.4 0
变化量(mol):0.32 0.16 0.32
平衡量(mol):0.08 0.08 0.32
再根据K=$\frac{{c}^{2}(C)}{{c}^{2}(A)×c(B)}$计算平衡常数;
D.绝热容器中,压缩体积,压强增大,平衡正向移动,正反应为放热反应,体系温度升高,又使平衡逆向移动,平衡常数减小.
解答 解:A.平衡时A的转化率为80%,则A的浓度变化量为$\frac{0.4mol×80%}{2L}$=0.16mol/L,甲从开始到平衡时ν(A)=$\frac{0.16mol}{5min}$=0.032mol•L-1•min-1,故A正确;
B.乙与甲相比,等效为在甲平衡的基础上加入0.4molA,A的转化率比甲中的小,而丙等效为在甲的基础压强增大一倍,平衡正向移动,A的转化率大于甲中,则平衡时A的转化率:α1<80%<α2,故B正确;
C.甲中平衡时,平衡时A的转化率为80%,转化的A为0.4mol×80%=0.32mol,则:
2A(g)+B(g)?2C(g)
起始量(mol):0.4 2.4 0
变化量(mol):0.32 0.16 0.32
平衡量(mol):0.08 0.08 0.32
故平衡常数K=$\frac{{c}^{2}(C)}{{c}^{2}(A)×c(B)}$=$\frac{(\frac{0.32}{2})^{2}}{(\frac{0.08}{2})^{2}×\frac{0.08}{2}}$=400,故C正确;
D.绝热容器中,压缩体积,压强增大,平衡正向移动,正反应为放热反应,体系温度升高,又使平衡逆向移动,平衡常数减小,则绝热容器中,压缩体积,平衡常数K<400 L/mol,故D错误,
故选:D.
点评 本题考查化学平衡计算、反应速率计算、化学平衡影响因素、平衡常数计算等,B中注意利用等效思想根据平衡建立的途径,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝可作胃酸过多的中和剂 | |
| B. | 为了防止中秋月饼等富脂食品氧化变质,延长食品保质期,在包装袋中常放入生石灰 | |
| C. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则指的是对应的钙离子和铁离子 | |
| D. | PM2.5是指大气中直径接近2.5微米的颗粒物,入肺影响健康,这种颗粒物分散空气中形成胶体,它具有丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 | 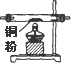 |  |  |  | 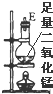 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验编号 | n(H 2)/n(CO) | T/℃ | P/MPa |
| i | m1 | 250 | 1 |
| ii | 3 | T1 | 5 |
| iii | m2 | 350 | P1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同物质的量浓度的三种溶液的pH:a>b>c | |
| B. | 同pH时,三种溶液稀释相同倍数后,pH:a>b<c | |
| C. | 同pH、同体积的三种溶液消耗同浓度盐酸 的体积:a=b=c | |
| D. | 同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
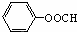 (写出结构简式).
(写出结构简式). +3NaOH→C17H35COONa+
+3NaOH→C17H35COONa+ .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com