
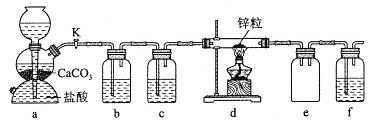
【题目】某学习小组拟探究CO2和锌粒反应是否生成CO,已知CO能与银氨溶液反应产生黑色固体。实验装置如图所示:
下列说法正确的是
A. 实验开始时,先点燃酒精灯,后打开活塞K
B. b、c、f中试剂依次为氢氧化钠溶液、浓硫酸、银氨溶液
C. 装置e的作用是收集一氧化碳气体
D. 用上述装置(另择试剂)可以制备氢气并探究其还原性
【答案】D
【解析】
探究CO2和锌粒反应是否生成CO,已知CO能与银氨溶液反应产生黑色固体,a装置是二氧化碳气体发生装置,生成的二氧化碳气体含有氯化氢和水蒸气,通过b中饱和碳酸氢钠溶液除去氯化氢,装置c中浓硫酸除去水蒸气,通过 d加热和锌发生反应,生成的气体通过装置e分离二氧化碳和一氧化碳,一氧化碳进入装置f中的银氨溶液产生黑色固体,验证一氧化碳的存在,据此分析判断选项。
通过上述分析可知装置图中各个装置的作用分别是:a装置是二氧化碳气体发生装置,生成的二氧化碳气体含有氯化氢和水蒸气,通过b中饱和碳酸氢钠溶液除去氯化氢,装置c中浓硫酸除去水蒸气,通过 d加热和锌发生反应,生成的气体通过装置e分离二氧化碳和一氧化碳,一氧化碳进入装置f中的银氨溶液产生黑色固体,验证一氧化碳的存在。
A.实验开始时,装置内含有空气,若先点燃酒精灯,锌与空气反应产生ZnO,无法使CO2与ZnO反应,所以应该先打开活塞K,使CO2充满整个装置后再点燃酒精灯,A错误;
B.通过前面分析可知b中试剂为饱和碳酸氢钠溶液,用来除去杂质氯化氢;c中试剂为浓硫酸,用来干燥CO2气体;f中试剂为银氨溶液,验证一氧化碳的存在,B错误;
C.装置e的作用是分离二氧化碳与一氧化碳的混合气体,C错误;
D.由于在实验室中是用稀盐酸与Zn粒反应制取氢气,反应不需要加热,因此也可以使用启普发生器制取,然后用饱和食盐水或水除HCl杂质,用浓硫酸干燥氢气,再通过盛有CuO的干燥管来验证H2的还原性,e作安全瓶,可以防止倒吸现象的发生,氢气是可燃性气体,在排放前要进行尾气处理,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1 = -870.3KJ/mol
(2)C(s)+O2(g)=CO2(g) △H2 = -393.5KJ/mol
(3)H2(g)+![]() O2(g)=H2O(l) △H3 = -285.8KJ/mol
O2(g)=H2O(l) △H3 = -285.8KJ/mol
试计算下列反应的反应热:
2C(s)+2H2(g)+O2(g)=CH3COOH(l) H =
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是

A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应![]() 的能量变化如图所示:
的能量变化如图所示:
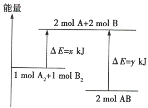
(1)2mol AB的总能量___________________(填“高于”或“低于”)1mol A2和1mol B2的总能量,该反应为___________(填“吸收”或“释放”)能量的反应。
(2)断裂2mol A2和2mol B2的化学键需吸收______kJ能量,断裂1.5mol AB的化学键需吸收_____kJ能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
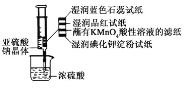
A.湿润的蓝色石蕊试纸先变红后褪色
B.湿润的品红试纸,蘸有KMnO4酸性溶液的滤纸均褪色证明了SO2的漂白性
C.湿润的碘化钾淀粉试纸变蓝说明SO2将I-还原为I2
D.实验后,可把注射器中的物质推入NaOH溶液,以减少环境污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系:aA(g)+bB(g)![]() cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
A. 若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.45倍,则a+b>c+d
B. 若从正反应开始,平衡时A、B的转化率相等,则投入A、B物质的量之比为 a:b
C. 若平衡体系中共有气体M mol,再向其中充入bmolB,达到平衡时气体总物质的量为(M+b)mol,则a+b>c+d
D. 若a+b=c+d,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气(CO和H2)是目前化工常用的原料,下面是用甲烷制备合成气的两种方法:
① CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
② 2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。
2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。
其中一个反应的反应过程与能量变化关系如图所示。则下列说法正确的是( )

A. E1表示2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g)的活化能
2CO(g)+4H2(g)的活化能
B. E2表示CH4(g)+H2O(g)![]() CO(g)+3H2(g)的活化能
CO(g)+3H2(g)的活化能
C. 该图示为反应②的反应过程与能量变化示意图
D. 一般情况下,加入催化剂,既能降低E1,也能降低E2,但不能改变E1与E2的差值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g)的平衡常数K随温度的变化如下表,下列说法正确的是 ( )
H2(g) + CO2(g)的平衡常数K随温度的变化如下表,下列说法正确的是 ( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A.该反应的正反应是吸热反应
B.恒温时减小容器体积增大压强,正反应速率增大
C.830 ℃时,反应达到平衡,一定是c(CO) = c(CO2)
D.400 ℃时,生成CO2物质的量越多,平衡常数K越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com