
【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑩ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是________(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是____________,碱性最强的化合物的化学式是______________________________。
(3)最高价氧化物是两性氧化物的元素是__________;写出它的氧化物与氢氧化钠反应的离子方程_________________________________________________。
(4)元素②形成的气态氢化物为_______________________(填化学式),检验该气体的方法为________________。
(5)原子半径最大的是_______(填元素符号),①②③三种元素气态氢化物稳定性由强到弱:____>____>____(填化学式,下同)。
(6) ④和⑤⑩三种元素最高价氧化物的水化物的碱性由强到弱顺序的是:____>____>____。
(7)④⑨和⑩三种元素所形成的简单离子的半径大小次序是:_______<_______<________。
【答案】Ar HClO4 KOH Al Al2O3+2OH-=2![]() +H2O NH3 用湿润的红色石蕊试纸(变蓝)检验或用蘸有浓盐酸的玻璃棒靠近瓶口,观察是否有白烟产生进行检验 K H2O NH3 CH4 NaOH Mg(OH)2 Al(OH)3 Mg2+ Na+ K+
+H2O NH3 用湿润的红色石蕊试纸(变蓝)检验或用蘸有浓盐酸的玻璃棒靠近瓶口,观察是否有白烟产生进行检验 K H2O NH3 CH4 NaOH Mg(OH)2 Al(OH)3 Mg2+ Na+ K+
【解析】
根据周期表中元素的位置关系,可知①为C元素,②为N元素,③为O元素,④为Na元素,⑤为Al元素,⑥为S元素,⑦为Cl元素,⑧是Ar元素,⑨为K元素,⑩为Mg元素,据此进行分析。
(1)在元素周期表中,0族元素原子最外层已达2电子或8电子稳定结构,化学性质不活泼,故答案为:Ar;
(2)根据同一周期,从左至右非金属性逐渐增强,其最高价氧化物对应水化物的酸性也逐渐增强;同一主族,从上至下,金属性逐渐增强,其最高价氧化物对应水化物的碱性也逐渐增强,可知,HClO4的酸性最强,KOH的碱性最强。答案为:HClO4;KOH;
(3)Al2O3既能与酸反应,也能与碱反应,故Al2O3为两性氧化物。Al2O3与NaOH反应生成NaAlO2和H2O,离子方程式为:Al2O3+2OH-=2![]() +H2O;答案为:Al;Al2O3+2OH-=2
+H2O;答案为:Al;Al2O3+2OH-=2![]() +H2O;
+H2O;
(4)由分析可知,②为N元素,其气态氢化物为NH3,NH3可使湿润的红色石蕊试纸变蓝,可与浓盐酸反应,生成NH4Cl,有白烟产生,故可用这两种方法进行检验。答案为:NH3;用湿润的红色石蕊试纸(变蓝)检验或用蘸有浓盐酸的玻璃棒靠近瓶口,观察是否有白烟产生进行检验;
(5)根据同一周期从左到右,原子半径逐渐减小,同一主族从上到下,原子半径逐渐增大,可知原子半径最大的是K;同一周期,非金属性:C<N<O,则其气态氢化物的稳定性为:H2O>NH3>CH4,答案为:K;H2O;NH3;CH4;
(6)同一周期元素的金属性:Na>Mg>Al,则其最高价氧化物对应水化物的碱性:NaOH>Mg(OH)2>Al(OH)3。答案为:NaOH;Mg(OH)2;Al(OH)3;
(7)电子层结构相同的离子,核电荷数越大,半径越小,可知离子半径:Na+>Mg2+;根据带相同电荷的离子,电子层数越多,半径越大,可知离子半径:K+>Na+,故离子半径大小次序是:Mg2+<Na+<K+。答案为:Mg2+;Na+;K+。


科目:高中化学 来源: 题型:
【题目】海水综合利用要符合可持续发展的原则,其联合工业体系(部分)如图所示,下列说法错误的是
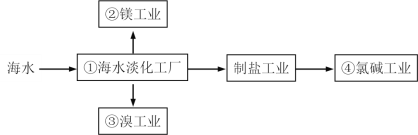
A.①中可采用蒸馏法B.②中可通过电解法制金属镁
C.③中提溴涉及到复分解反应D.④的产品可生产盐酸、漂白液等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是
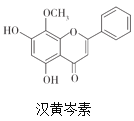
A. 能与Na2CO3溶液反应放出气体
B. 该物质遇FeCl3溶液不显色
C. 1mol该物质与溴水反应,最多消耗2molBr2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式书写不正确的是
A. 用FeCl3溶液腐蚀印刷线路板上的Cu:2Fe3++Cu=2Fe2++Cu2+
B. 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
C. 稀硝酸中加入过量铁粉: Fe+4H++NO3-=Fe3++NO↑+2H2O
D. 用Na2CO3溶液浸泡锅炉水垢:CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)
CaCO3(s)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氮的变化关系图如下:
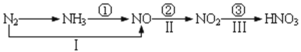
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线ⅠⅡ Ⅲ是雷电固氮生成硝酸的主要途径
C.氮气可在足量的氧气中通过一步反应生成NO2
D.上述所有反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难溶性杂卤石(K2SO4MgSO42CaSO42H2O)在水中存在如下平衡K2SO4MgSO42CaSO42H2O (s)![]() 2Ca2++2K++ Mg2++4SO42-+2H2O,为能充分利用钾资源,用足量的饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾。工艺流程是:首先需要溶浸与分离,见下图:
2Ca2++2K++ Mg2++4SO42-+2H2O,为能充分利用钾资源,用足量的饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾。工艺流程是:首先需要溶浸与分离,见下图:

(1)不同温度下,K+的浸出浓度与溶浸时间的关系如下图,由图可得,随着温度升高①________________;②______________。

(2)为了提高浸出效率,可采取的措施是:________;过滤用到的玻璃仪器名称是:______。
(3)滤渣主要成分有_________和_________以及未溶杂卤石,用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石、浸出K+的原因: _________________________________。
(4) 溶浸与分离过滤后,滤液中的主要杂质离子是______,进一步“除杂”环节见下图。可先加入______溶液,经搅拌等操作后,过滤,再加入_________溶液调滤液pH至中性。

(5)中过滤得到的母液中含有大量的_____(填写化学式),检验其中溶质阴离子的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在蒸馏实验中,下列叙述不正确的是( )
A.在蒸馏烧瓶中盛约![]() 体积的自来水,并放入几粒沸石
体积的自来水,并放入几粒沸石
B.将温度计水银球插入自来水中
C.冷水从冷凝管下口入,上口出
D.收集蒸馏水时,应弃去开始馏出的部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)等物质的量的CO与CO2之间:二者的质量之比为______,所含氧原子数之比为______。
(2)在标准状况下,CO和CO2混合气体的质量为32g,体积为22.4L,则混合气体中CO的体积为______, CO2的质量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+),形成沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)关系如图所示。下列说法不正确的是

A. 若向沉淀剂Na2S溶液通入HC1气体至中性,存在关系: c(HS-)+2c(H2S)=c(Cl-)
B. 该温度下,Ksp(MnS)大于1.0×10-35
C. 若将MnS、FeS的饱和溶液等体积混合,再加入足量的浓 Na2S溶液,发生的反应为MnS沉淀少于FeS
D. 向l00mL浓度均为10-5mol·L-1Zn2+、Fe2+、Mn2+的混合溶液中逐滴加入10-4mol·L-1Na2S溶液,ZnS先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com