
【题目】CO2、碳酸盐、有机物等均是自然界碳循环中的重要物质。回答下列问题:
(1)下列物质属于化合物但不属于电解质的是______(填字母)。
A.石墨 B.汽油 C.乙醇 D.碳酸
(2)倍半碳酸钠(Na2CO3·NaHCO3·2H2O)在水溶液中的电离方程式为__________________________。
(3)金属钠在足量CO2中燃烧生成常见的盐和单质,写出反应的化学方程式:____________。
(4)铜器表面的难溶物Cu2(OH)2CO3可用稀硫酸洗涤除去,该反应的离子方程式为________________。
(5)工业上制取金刚砂的反应为: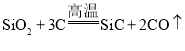 ,该反应中氧化剂与还原剂的物质的量之比为______。
,该反应中氧化剂与还原剂的物质的量之比为______。
【答案】C 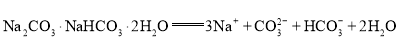 (或
(或![]() )
) 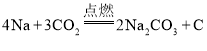
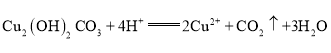 1∶2
1∶2
【解析】
(1) 电解质是在水溶液中或在熔融状态下能够导电的化合物,
A.石墨属于单质,石墨既不是电解质、也不是非电解质;
B.汽油是混合物,汽油既不是电解质、也不是非电解质;
C.乙醇在水溶液和熔融状态下都不能导电,乙醇属于非电解质;
D.碳酸是化合物,其水溶液可导电,属于电解质;
答案选C。
(2)Na2CO3电离为Na+和![]() ,NaHCO3电离为Na+和
,NaHCO3电离为Na+和![]() ,故
,故![]() 在水溶液中的电离方程式为
在水溶液中的电离方程式为![]() ;
;
(3)由题意知,Na与CO2在点燃条件下反应生成Na2CO3和C,配平的方程式为 ;
;
(4)Cu2(OH)2CO3难溶,写化学式,与硫酸反应生成CuSO4、CO2和H2O,硫酸与CuSO4写成离子形式,两边删去等量![]() 得离子方程式:
得离子方程式:![]() ;
;
(5)C既是氧化剂,又是还原剂;C→SiC,碳被还原,作氧化剂;C→CO,碳被氧化,作还原剂,氧化剂与还原剂的物质的量之比为1∶2。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】以氯化氢为原料通过直接氧化法可以制取氯气,反应方程式为:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) 。
(1)该法可按下列催化过程进行:
CuCl2(s)CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+![]() O2(g)CuO(s)+
O2(g)CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
①总反应4HCl(g)+O2(g)2Cl2(g)+2H2O(g)的ΔH=____kJ·mol-1。
②有利于提高总反应平衡产率的条件有______。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)恒温恒压下,可以说明总反应4HCl(g)+O2(g)2Cl2(g)+2H2O(g)达到平衡的是_________。
A.压强不变
B.氯气的体积分数保持不变
C.每生成2个H—O的同时,有4个H—Cl生成
D.反应速率v正(O2)∶v逆(H2O)=1∶2
E.各组分的物质的量浓度都相等

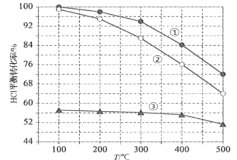
(3)密闭容器中充入HCl和O2进行反应,c(HCl)随时间t的变化曲线如图1,保持其他条件不变,t2时升温,t3时重新达平衡,画出t2—t4时c(Cl2)随时间t的变化曲线____。
(4)在刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时,HCl平衡转化率随温度变化的关系如图2:
①其中曲线①代表的c(HCl) ∶c(O2)是__________,原因__________。
②设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=4∶1的数据计算K(400℃)=__________(列出计算式,不必算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)第四周期中,未成对电子数最多的元素是________,(填名称)它位于第________族;核外电子排布式是__________________。它有________种运动状态不同的电子,其价电子排布图为:______________。
(2)已知NH5为离子化合物,写出其电子式:________。
(3)某同学根据掌握的知识分析Mg的核外电子排布为![]() 。该同学所画的电子排布图违背了________。
。该同学所画的电子排布图违背了________。
(4)在基态 14C原子中,核外存在________对自旋相反的电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,也可由咖啡酸合成,下列说法不正确的是( )
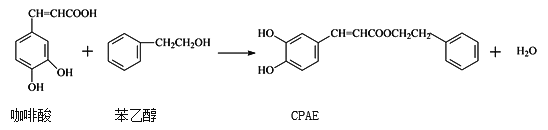
A. 1mol CPAE与足量的溴水反应,最多消耗4mol Br2
B. 咖啡酸可发生聚合反应,而且其分子中含有3种官能团
C. 与苯乙醇互为同分异构体的酚类物质共有9种
D. 可用金属Na检测上述反应是否残留苯乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新研究表明,咖啡中含有的咖啡酸能使人心脑血管更年轻。咖啡酸的球棍模型如图所示,下列有关咖啡酸的叙述不正确的是( )

A.咖啡酸的分子式为C9H8O4
B.咖啡酸中的含氧官能团只有羧基、酚羟基
C.咖啡酸可以发生氧化反应、消去反应、酯化反应、加聚反应
D.![]() 是咖啡酸的一种同分异构体,1mol该物质最多可消耗3molNaOH
是咖啡酸的一种同分异构体,1mol该物质最多可消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.石油分馏、煤的干馏都是物理变化
B.![]() 和
和![]() 为同一种物质
为同一种物质
C.油脂的“皂化”即为油脂的“硬化”
D.糖类、油脂和蛋白质均是天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铬(CrN)薄膜具有韧性高、耐磨性好、涂层结合强度高、更好的抗高温氧化性和抗腐蚀性以及内应力低等优点,在汽车工业、航空航天等领域取得了很好的应用效果。某化学兴趣小组利用下列装置进行氮化铬的制备(部分夹持装置已略),回答下列问题:
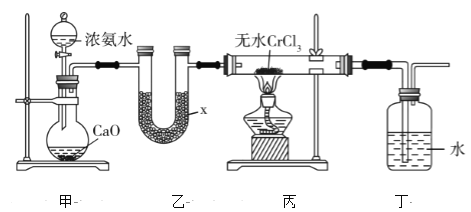
(1)仪器x的名称为________,x中盛有的试剂为干燥剂,该干燥剂可以是________(填字母)。
a.浓硫酸 b.碱石灰 c.CaO d.无水CaCl2
(2)装置甲中CaO可用NaOH固体代替,其原因是_______________________________________________。
(3)若装置丙玻璃管中产生大量白烟,则发生反应的化学方程式为__________________________________。
(4)装置丁洗气瓶中水的作用是________________________________________。该装置是否合适?合适则写出合适的理由,不合适则说明改进措施:_____________________________________________________
(5)实验前,在装置丙中加入15.850g CrCl3,实验结束后,取出装置丙中的固体加热至质量不再减少,称量剩余固体质量为7.525g,则制备的产品纯度为______%(保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。其工作原理如下图所示,下列说法正确的是
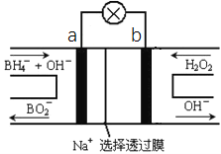
A. 电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
B. 放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4
C. 电池放电时Na+从b极区移向a极区
D. 电极a采用MnO2,MnO2既作电极材料又有催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.将纯水加热的过程中,Kw变大、pH变小
B.配制FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1mol/L氨水中加入少量水,溶液中![]() 减小
减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com