
 HR是含Z元素的一元酸.室温时,用0.250mol?L-1 NaOH溶液滴定25.0mL HR溶液时,溶液的pH变化情况如图所示.其中,a点表示两种物质恰好完全反应.
HR是含Z元素的一元酸.室温时,用0.250mol?L-1 NaOH溶液滴定25.0mL HR溶液时,溶液的pH变化情况如图所示.其中,a点表示两种物质恰好完全反应.| n(NaOH) |
| V(HR) |
| 0.250mol/L×0.02L |
| 0.025L |
| n(NaOH) |
| V(HR) |
| 0.250mol/L×0.02L |
| 0.025L |
| (H+)?c(R-) |
| c(HR) |
| 0.001×0.001 |
| 0.2-0.001 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
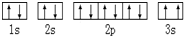 ,违背了
,违背了查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 L 9.5mol/L的NaOH溶液 |
| B、2 L 0.4mol/L的NaN03溶液 |
| C、3L 0.3moI/L的NaCl溶液 |
| D、1 L 0.2mol/L的Na3P04溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com