


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
| 浓H2SO4 |
| 分解 |
| 浓NaOH溶液 |
| 水蒸气 |
| 营养成分:每100克内含 | |
| 脂肪 | ≥3.3克 |
| 蛋白质 | ≥2.9克 |
| 非脂乳固体 | ≥8.5克 |
查看答案和解析>>
科目:高中化学 来源: 题型:
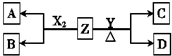 由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如图(其他无关物质已略去).请回答下列问题:
由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如图(其他无关物质已略去).请回答下列问题:| 元素X | 易形成-1价18电子的单核离子 |
| 元素Y | 第3周期第ⅥA族 |
| 化合物Z | 所含阳离子有3个电子层 |
| 常温下0.1mol?L-1的水溶液pH=13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 HR是含Z元素的一元酸.室温时,用0.250mol?L-1 NaOH溶液滴定25.0mL HR溶液时,溶液的pH变化情况如图所示.其中,a点表示两种物质恰好完全反应.
HR是含Z元素的一元酸.室温时,用0.250mol?L-1 NaOH溶液滴定25.0mL HR溶液时,溶液的pH变化情况如图所示.其中,a点表示两种物质恰好完全反应.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+H2O=HCl+HClO |
| B、2Na2O2+2H2O=4NaOH+O2↑ |
| C、2H2S+SO2=3S↓+2H2O |
| D、Fe2O3+6HCl=2FeCl3+3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com