
| ||
| ||
| ||
| ||
| 88g |
| 44g/mol |
| 0.224L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
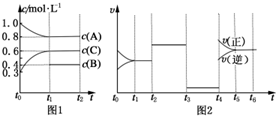 向体积为2L的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)?3C(g)△H>0,各物质的浓度随时间变化的关系如图1所示,其中t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2,t3,t4各改变一种不同的条件.
向体积为2L的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)?3C(g)△H>0,各物质的浓度随时间变化的关系如图1所示,其中t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2,t3,t4各改变一种不同的条件.查看答案和解析>>
科目:高中化学 来源: 题型:
 HR是含Z元素的一元酸.室温时,用0.250mol?L-1 NaOH溶液滴定25.0mL HR溶液时,溶液的pH变化情况如图所示.其中,a点表示两种物质恰好完全反应.
HR是含Z元素的一元酸.室温时,用0.250mol?L-1 NaOH溶液滴定25.0mL HR溶液时,溶液的pH变化情况如图所示.其中,a点表示两种物质恰好完全反应.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量 |
| B、该反应的焓变大于零 |
| C、该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量 |
| D、由该反应可推出凡是需要加热才发生的反应均为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应中既有旧化学键的断裂,也有新化学键的生成 |
| B、该反应中每消耗1molNa,则同时消耗18gH2O,产生1molNaOH和11.2LH2(标况下) |
| C、由于该反应常温下能自动进行,所以该反应一定是放热反应 |
| D、由于该反应是放热反应,所以断裂旧化学键所吸收的能量一定比形成新化学键所放出的能量少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com