
【题目】下列做法错误的是( )
A.用镊子从试剂瓶中夹取钠块
B.用水清洗试管内壁附着的硫
C.采用“扇闻”的方法闻氯气的气味
D.用洁净的铂丝蘸取溶液进行焰色反应的实验
科目:高中化学 来源: 题型:
【题目】下列有关原电池、电解池和电化学腐蚀的说法正确的是( )


A.图a是原电池,可以实现化学能转化为电能
B.图b电解一段时间后,加入适量CuO固体,可以使硫酸铜溶液恢复到原浓度
C.图c装置可以防止铁钉生锈
D.图d在轮船铁质外壳上镶嵌锡块,可减缓船体的腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知Zn+CuSO4=Cu+ZnSO4,设计成原电池,构造如图所示,试问CuSO4溶液放在 (填“甲”或“乙”)烧杯,盐桥中的Cl-移向 (填“甲”或“乙”)烧杯;
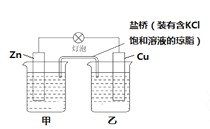
(2)已知①C(s)+ O2(g ) = CO2(g) ΔH=-393.5kJ/mol
②CO(g)+ ![]() O2(g) = CO2(g) ΔH=-283.0kJ/mol
O2(g) = CO2(g) ΔH=-283.0kJ/mol
请写出C转化为CO的热化学方程式: 。
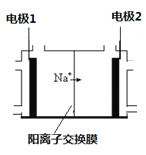
(3)电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”。在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式 ,其中右图是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息(通电以后Na+的移动方向)判断电极2的名称是 ,并写出电极1的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质Ni的原理如图。下列说法不正确的是( )
已知:

①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH— -4e—==O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A. 放电时负极反应为:Zn-2e-+2OH-===Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-===FeO42-+4H2O
C. 充电时,蓄电池的负极应与外接电源正极相连
D. 放电时负极附近溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是

A.图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀量的关系曲线
B.图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C.图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线
D.图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2 min末浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.增大平衡后的体系压强,v(正)增大,v(逆)减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·(L·min)-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com