
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
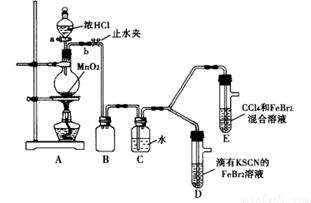
(1)①连接仪器:把玻璃导管插入橡胶塞的操作是: ,然后对准橡胶塞上得空稍稍用力转动,将其插入。
②检查气体发生装置A的气密性的操作是: ,向分液漏斗中注水,若水不能顺利流下,则气密性良好。
(2)整套实验装置存在一处明显不足,请指出 。
用改正后的装置进行实验。实验过程如下:

(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化:
D装置中:红色慢慢褪去。
E装置中:CC14层先由无色变为橙色,后颜色逐渐变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:

①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因 ,请设计简单实验证明上述解释: 。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因 。
(1)①先将玻璃管口用水润湿 (2分)
关闭止水夹b,打开活塞a (2分)
(2)缺少尾气处理装置(2分) Cl2 > Br2 > Fe3+ (2分)
(3)①过量氯气和SCN–反应2SCN- + Cl2= 2Cl- +
(SCN)2,使SCN-浓度减小,使Fe3+ +3SCN- Fe(SCN)3 平衡向逆反应方向移动而褪色。(2分)
Fe(SCN)3 平衡向逆反应方向移动而褪色。(2分)
取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理。
或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理。(其它合理答案也得分)(2分)
②BrCl + H2O = HBrO + HCl反应产生Cl-,由于AgBrO易溶于水,加入AgNO3溶液,只能生成AgCl沉淀。(2分)
【解析】
试题分析:本题探究氧化性的强弱,用强制弱的原理进行相关的实验。这个实验的流程为制取氯气→收集(安全瓶)→净化氯气(除HCl)→然后进行实验。在两组实验中可以对比是先氧化Fe2+还是Br-。从而得到相关的结论。
(2)A装置中产生氯气,D装置中溶液变红,这说明反应中有Fe3+生成,即氯气将亚铁离子转化为铁离子。E装置中水层溶液变黄,振荡后,CCl4层无明显变化,这说明反应中氯气首先氧化亚铁离子,所以根据氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性可知,氧化性强弱顺序是Cl2 >Br2 >Fe3+。
(3)①因为氧化性是Cl2>(SCN)2,所以过量氯气和SCN-反应:2SCN-+Cl2→2Cl-+(SCN)2,使SCN-浓度减小,则可逆反应Fe3++3SCN-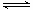 Fe(SCN)3
平衡逆向移动而褪色。要证明上述结论,可以根据平衡移动原理,即取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理。(或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理。
Fe(SCN)3
平衡逆向移动而褪色。要证明上述结论,可以根据平衡移动原理,即取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理。(或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理。
②由于过量的Cl2和Br2反应生成的BrCl,BrCl与水发生水解反应生成盐酸和次溴酸,反应的方程式是BrCl + H2O →HBrO + HCl。反应只产生Cl-,不产生Br-,所以只能得到白色沉淀氯化银,得不到溴化银浅黄色沉淀。
考点:本题是综合实验探究,考查信息的加工、整合、处理能力。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:阅读理解
 某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.
某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
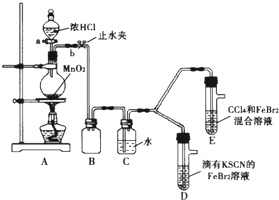 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄 振荡后CCl4层无明显变化 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
| Ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点为5℃,与水发生水解反应. Ⅲ.AgClO、AgBrO均可溶于水. |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com