
【题目】硫酸是基础化工的重要产品,硫酸的消费量可作为衡量一个国家工业发展水平的标志。生产硫酸的主要反应为:SO2(g)+ 1/2O2(g) ![]() SO3(g)。
SO3(g)。
(1)恒温恒压下,平衡体系中SO3的体积分数和y与SO2、O2的物质的量之比的关系如图1:则b点n(SO2)/n(O2)=________________;y为_____________(填编号)。

A.平衡常数
B.SO3的平衡产率
C.O2的平衡转化率
D.SO2的平衡转化率
(2)Kp是以各气体平衡分压代替浓度平衡常数Kc中各气体的浓度的平衡常数。在400~650℃时,Kp与温度(T /K)的关系为lgKp= - 4.6455,则在此条件下SO2转化为SO3反应的ΔH_______(填“>0”或“<0”)。
(3)①该反应的催化剂为V2O5,其催化反应过程为:
SO2+V2O5![]() SO3+V2O4 K1 1/2O2+V2O4
SO3+V2O4 K1 1/2O2+V2O4![]() V2O5 K2
V2O5 K2
则在相同温度下2SO2(g)+O2(g) ![]() 2SO3(g)的平衡常数K=____________(以含K1、K2的代数式表示)。
2SO3(g)的平衡常数K=____________(以含K1、K2的代数式表示)。
②V2O5加快反应速率的原因是_____________________________。
(4)在7.0% SO2、11% O2、82% N2(数值均为气体体积分数)时,SO2平衡转化率与温度、压强的关系如图2,则列式计算460℃、1.0 atm下,SO2(g)+1/2 O2(g) ![]() SO3(g)的Kp=_______(已知:各气体的分压=总压×各气体的体积分数)。
SO3(g)的Kp=_______(已知:各气体的分压=总压×各气体的体积分数)。

(5)综合第(4)题图给信息,工业生产压强通常采用常压的原因是__________________________。
【答案】 2 D <0 (K1×K2)2 降低反应的活化能,活化分子百分数增大,有效碰撞几率提高 Kp=113/atm1/2 常压下SO2的平衡转化率已经很大,再增大压强,对设备要求较高
【解析】(1)当二氧化硫的量与氧气的物质的量之比等于系数之比时三氧化硫的体积分数最大,b点三氧化硫体积分数最大,此点处n(SO2)/n(O2)=2:1;由图象可知,n(SO2)/n(O2)越大,y值越小,A.平衡常数仅与温度有关,所以n(SO2)/n(O2)变化,平衡常数不变,不符合图像,故错误;B.n(SO2)/n(O2)越大,二氧化硫物质的量越大,则SO3的平衡产率越大,不符合图像,故错误;C.n(SO2)/n(O2)越大,二氧化硫物质的量越大,则O2的转化率越大,不符合图像,故错误;D.n(SO2)/n(O2)越大,二氧化硫物质的量越大,则SO2的平衡转化率越小,符合图像,故正确;故选D;故答案为:2;D;
(2)根据图知,升高温度平衡常数减小,说明平衡逆向移动,正反应是放热反应,焓变小于0,故答案为:<0;
(3)将方程式2(①+②)得2SO2(g)+O2(g)![]() 2SO3(g),方程式相加平衡常数相乘,方程式扩大2倍,平衡常数变为原来的平方,所以该反应化学平衡常数K等于(K1×K2)2,故答案为:(K1×K2)2;
2SO3(g),方程式相加平衡常数相乘,方程式扩大2倍,平衡常数变为原来的平方,所以该反应化学平衡常数K等于(K1×K2)2,故答案为:(K1×K2)2;
(4)混合气体中7.0%SO2、11%O2、82%N2,假设有混合气体100mol,则二氧化硫为7mol、氧气11mol、氮气82mol,460℃、1.0atm下二氧化硫转化率为97%,则参加反应的n(SO2)=7mol×97%=6.79mol,剩余的n(SO2)=7mol×3%=0.21mol,剩余的n(O2)=11mol-![]() ×6.79mol=7.605mol,生成的三氧化硫物质的量=6.79mol,反应后混合气体总物质的量=0.21mol+7.605mol+6.79mol +82mol =96.605mol,反应前后物质的量之比等于其压强之比,则反应后压强=
×6.79mol=7.605mol,生成的三氧化硫物质的量=6.79mol,反应后混合气体总物质的量=0.21mol+7.605mol+6.79mol +82mol =96.605mol,反应前后物质的量之比等于其压强之比,则反应后压强=![]() ×1atm=0.9579atm,二氧化硫的分压=
×1atm=0.9579atm,二氧化硫的分压=![]() ×0.9579atm,氧气分压=
×0.9579atm,氧气分压=![]() ×0.9579atm,三氧化硫分压=
×0.9579atm,三氧化硫分压=![]() ×0.9579atm,化学平衡常数Kp=
×0.9579atm,化学平衡常数Kp= =
= =113/atm1/2,故答案为:113/atm1/2;
=113/atm1/2,故答案为:113/atm1/2;
(5)根据图知,在400~500℃时二氧化硫转化率较大,反应速率快,此时催化剂的活性最高,所以工业生产最适宜的温度范围为400~500℃,又常压下SO2的平衡转化率已经很大,再增大压强,对设备要求较高,故答案为:常压下SO2的平衡转化率已经很大,再增大压强,对设备要求较高。


科目:高中化学 来源: 题型:
【题目】如图是用实验室制得的乙烯(C2H5OH![]() CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是
CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是

A. 装置①和装置③中都盛有水,其作用相同
B. 装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同
C. 产物可用分液的方法进行分离,1,2﹣二溴乙烷应从分液漏斗的上口倒出
D. 制备乙烯和生成1,2﹣二溴乙烷的反应类型分别是消去反应和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有大量的下列离子:Mg2+ 、SO42—、Al3+和M离子,经测定Mg2+、SO42—、Al3+和M离子的物质的量之比为1︰4︰1︰1,则M离子可能是下列中的( )
A. Cl— B. Fe3+ C. OH— D. Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对危险化学药品要在包装标签上印上警示性标志。下列化学药品名称与警示标志名称对应正确的是( )
A. 酒精——剧毒品 B. 浓硫酸——腐蚀品
C. 汽油——爆炸品 D. 烧碱——剧毒品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需用2.0molL﹣1的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为( )
A.950 mL;201.4 g
B.1 000 mL;212.0 g
C.100 mL;21.2 g
D.500 mL;100.7 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种甜味剂A的甜度是蔗糖的200倍,由于它热值低、口感好、副作用小,已在90多个国家广泛使用。A的结构简式为:

已知:①在一定条件下,羧酸酯或羧酸与含—NH2的化合物反应可以生成酰胺,如:
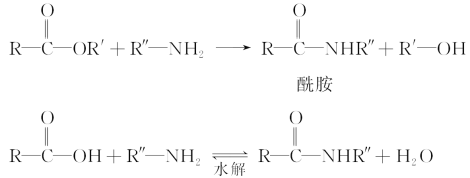
②酯比酰胺容易水解。请填写下列空白:
(1)在稀酸条件下加热,化合物A首先生成的水解产物是________和________。
(2)在较浓酸和长时间加热条件下,化合物A可以水解生成________、________和________。
(3)化合物A分子内的官能团之间也可以发生反应,再生成一个酰胺键,产物是甲醇和________________。(填写结构简式,该分子中除苯环以外,还含有一个六原子组成的环)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料表明,MnO2和Fe3+对H2O2制备O2均具有催化作用。某课外小组同学在实验室进行了验证试验并研究了H2O2其他性质。回答下列问题:
(1)现有三支分别盛有2 mL10% H2O2溶液的试管,甲同学在第一、第二支试管中分别加入MnO2和少量FeCl3溶液,发现均有大量气泡生成,向第三支试管中加入少量的盐酸溶液并观察现象,其目的是________。
(2)该同学查阅相关资料,获得催化机理如下图所示:
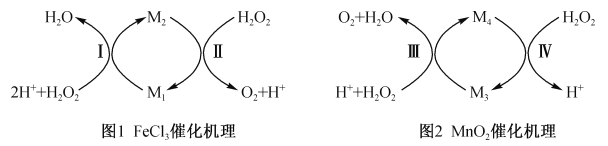
①图1中微粒M1是_______(填化学式)。
②图2中若M4为Mn2+,则反应Ⅲ的离子方程式为_____________。
(3)乙同学在试管中加入2 ml. 3%的H2O2溶液,0.5mL乙醚,l mL1 mol/LH2SO4溶液和3~4滴0.5mol/L的K2Cr2O7溶液,发现上层有机相为蓝色(CrO5的乙醚溶液),下层水相为无色。
①乙醚除作为CrO5的稳定剂外,另一作用是____________。
②一段时间后蓝色褪去,并产生大量的气泡同时水相中溶液变为绿色(含Cr3+),褪色反应的离子方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com