
【题目】L-多巴可用于帕金森综合症的治疗,其结构简式为 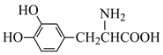 。下列关于L-多巴的说法中,不正确的是
。下列关于L-多巴的说法中,不正确的是
A.分子式为C9H12O4NB.能缩合生成高分子
C.能与酸、碱反应生成盐D.在空气中易变质
科目:高中化学 来源: 题型:
【题目】25℃时,用0.10mol·L的氨水滴定l0.00mL0.05mol·L-1H2A溶液,加入氨水的体积(V)与溶液中lg![]() 的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
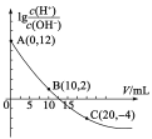
A.A点溶液的pH等于1
B.由图中数据可知,H2A为弱酸
C.B点水电离出的H+离子浓度为1.0×10-6mol·L-1
D.C点溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法正确的是( )
A.制钛:用金属钠置换氯化钛(![]() )溶液中的钛
)溶液中的钛
B.炼铁:用![]() 在高温下还原铁矿石中的铁
在高温下还原铁矿石中的铁
C.制钠:以海水为原料制得精盐,再电解纯净的![]() 溶液
溶液
D.炼铜:电解精炼黄铜矿得到纯度为99.9%的铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定微粒的数目相等的是( )
A.等物质的量的水与重水(D2O)含有的中子数
B.等质量的NO2和N2O4中含有的分子数目
C.同温、同压、同体积的两种气体CO和N2含有的质子数
D.等物质的量的铁和铝分别与 足量盐酸完全反应时转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业、硝酸工业和合成氨工业是重要的化学工业。
(1)①硫酸工业、②合成氨工业、③硝酸工业三大工业中,在生产过程中有化学平衡存在的工业有________(填序号;下同),采用循环操作的有________。
(2)合成氨工业中,根据化学平衡原理来确定的条件或措施有________(填序号)。
A 氮气的制取 B 使用铁触媒作催化剂 C 使用400~500℃的温度
D 及时分离生成的![]() E 合成氨在高压下进行 F 制水煤气除去
E 合成氨在高压下进行 F 制水煤气除去![]()
(3)工业上用接触法制硫酸,最后得到的产品是98%的硫酸或20%的发烟硫酸(含![]() 质量分数为20%的硫酸),若98%的硫酸表示为
质量分数为20%的硫酸),若98%的硫酸表示为![]() ,20%的发烟硫酸表示为
,20%的发烟硫酸表示为![]() ,则
,则![]() ________,
________,![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的短周期主族元素。X分别与Y、Z、W结合形成质子数相同的甲、乙、丙三种分子。丁为无色气体,遇空气变红棕色;丙的水溶液可刻蚀玻璃。
上述物质有如图转化关系:

下列说法错误的是
A. 四种元素形成的单质中W的氧化性最强
B. 甲、乙、丙中沸点最高的是丙
C. 甲常用作致冷剂
D. 甲、乙分子均只含极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍及其化合物的应用正日益被重视。
(1)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为____________。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有________(填字母)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.铍、镁和铝与氯气形成的化合物晶体类型相同
(3)铍、铝晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点(1551K)比铝的熔点(930K)高,原因是____________________。
(4)BeO立方晶胞如图所示,若BeO晶体的密度为dg·cm-3,则晶胞边长为________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是

A. a和b都属于芳香族化合物
B. a、b和c均能使酸性KMnO4溶液褪色
C. a和c分子中所有碳原子均处于同一平面上
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中具有广泛的用途。请回答下列问题:
(1)氰化物极毒,![]() 可以消除含氰废液中的
可以消除含氰废液中的![]() ,其中
,其中![]() 的电子式为________。
的电子式为________。
(2)碳酸亚铁![]() 是一种重要的工业盐,外观为白色固体,潮湿空气中易被氧化。用硫铁矿烧渣
是一种重要的工业盐,外观为白色固体,潮湿空气中易被氧化。用硫铁矿烧渣![]() 主要含
主要含![]() 、
、![]() 、少量
、少量![]() 制备
制备![]() 的工艺流程如下:
的工艺流程如下:

![]() “还原”时,发生反应的离子方程式为________。
“还原”时,发生反应的离子方程式为________。
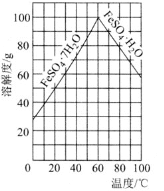
![]() 的溶解度曲线如图所示,欲获得
的溶解度曲线如图所示,欲获得![]() ,采用的实验操作是________。
,采用的实验操作是________。
![]() 在空气中煅烧可制备铁红,反应的化学方程式为________。
在空气中煅烧可制备铁红,反应的化学方程式为________。
![]() “沉淀”步骤中
“沉淀”步骤中![]() 达到沉淀溶解平衡时,若
达到沉淀溶解平衡时,若![]()
![]() ,欲使所得的
,欲使所得的![]() 中不含有
中不含有![]() ,应调节溶液的pH不超过________
,应调节溶液的pH不超过________![]() 已知:
已知:![]() ,
,![]() ,
,![]() 。
。
(3)铁镍电池结构、强度极好,循环寿命和工作寿命长。电池总反应为
![]() 。写出放电时的负极反应式:________。
。写出放电时的负极反应式:________。
(4)化合物![]() 为
为![]() 价
价![]() 为亮绿色晶体,可用于晒制蓝图。其组成测定实验如下:
为亮绿色晶体,可用于晒制蓝图。其组成测定实验如下:
步骤Ⅰ:称取0.491g![]() 置于锥形瓶中,加足量蒸馏水和稀
置于锥形瓶中,加足量蒸馏水和稀![]() ;
;
步骤Ⅱ:用![]()
![]() 溶液进行滴定,恰好反应时消耗
溶液进行滴定,恰好反应时消耗![]() 溶液
溶液![]() ;
;
步骤Ⅲ:再加入适当的还原剂,将![]() 完全转化为
完全转化为![]() ,用
,用![]() 溶液继续滴定,当
溶液继续滴定,当![]() 完全氧化时,消耗溶液
完全氧化时,消耗溶液![]() 溶液2.00mL。
溶液2.00mL。
![]() 步骤Ⅰ中加足量稀
步骤Ⅰ中加足量稀![]() 的目的是________。
的目的是________。
![]() 该化合物的化学式为________。
该化合物的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com