
����Ŀ���뼰�仯�����Ӧ�������汻���ӡ�
(1)����Ҫ�ĺ������������ʯ����2%��(Cr)������ʯ��Ϊ��ĸ�̡���̬Crԭ�Ӽ۵��ӵĹ����ʾʽΪ____________��
(2)���������������Ԫ���������ơ������й��������������ȷ����________(����ĸ)��
A.������p������Ԫ�� B.�縺�Զ���þ��
C.��һ�����ܶ���þ�� D.�롢þ�����������γɵĻ����ᄃ��������ͬ
(3)�롢�����嶼���ɽ���ԭ�����ò�����ά�ռ�ѻ�����(���ܶѻ�)������۵�(1551K)�������۵�(930K)�ߣ�ԭ����____________________��
(4)BeO����������ͼ��ʾ����BeO������ܶ�Ϊdg��cm-3�����߳�Ϊ________nm��

���𰸡�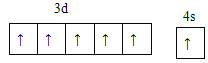 B Beԭ�Ӱ뾶��AlС
B Beԭ�Ӱ뾶��AlС ![]()
��������
(1)Cr��24��Ԫ�أ���ԭ�Ӻ�������Ų����������ȫ�����ȶ��ṹ���ݴ���д���̬ԭ�Ӽ۲�����Ų�ʽ��
(2)A.Be����s��Ԫ�أ�Al����p��Ԫ�أ�
B.Be��Al�ĵ縺�Զ���þ��
C.��������Ԫ��Mg�ĵ�һ�����ܱȵ�������Al�Ĵ�
D.�Ȼ�þ�����ӻ����BeCl2��AlCl3�ǹ��ۻ����
(3)���������۷е�������������ȣ���������ԭ�Ӱ뾶�ɷ��ȣ�
(4)���㾧���к��е�O2-��Be2+�ĸ�����Ȼ����ݾ����ܶ�![]() ����V=a3���㾧��������
����V=a3���㾧��������
(1)Cr����24��Ԫ�أ���ԭ�Ӻ�������Ų����������ȫ�����ȶ��ṹ����̬ԭ�Ӽ۲�����Ų�ʽΪ3d54s1�������Ų�ͼΪ�� ��
��
(2)���������������Ԫ���������ơ�
A.Be����s����Al����p����A����
B.Ԫ�صĽ�����Խǿ��Խ����ʧȥ���ӣ�Ԫ�صĵ縺�Ծ�ԽС������Be��Al�Ľ����Ա�Mg��������Ԫ�صĵ縺�Զ���þ��B��ȷ��
C.�������ڵ�IIAԪ��Mg�ĵ�һ�����ܱȵ������ڵ�IIIA��Al�Ĵ�C����
D.MgCl2�����ӻ������̬ʱ�������Ӿ��壬��BeCl2��AlCl3�ǹ��ۻ�����ڹ�̬ʱ���ڷ��Ӿ��壬���ʵľ������Ͳ���ͬ��D����
�ʺ���ѡ����B��
(3)Beԭ�Ӱ뾶��Alԭ�Ӱ뾶С����������ǿ������۵�������۵�ߣ�
(4)��BeO�����У��þ�����O2-����=8��![]() +6��
+6��![]() =4��Be2+����=1��4=4����BeO������ܶ�Ϊdg/cm3�����ݾ����ܶ�
=4��Be2+����=1��4=4����BeO������ܶ�Ϊdg/cm3�����ݾ����ܶ�![]() ����֪��������a=
����֪��������a=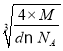 ��10-7nm=
��10-7nm=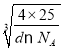 ��10-7nm=
��10-7nm=![]() nm��
nm��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F�Ǻ˵����������������ֶ���������Ԫ�أ�AԪ�ص�ԭ�Ӻ���ֻ��1�����ӣ�BԪ�ص�ԭ�Ӱ뾶����������������С�ģ�B������������Ӧˮ����Ļ�ѧʽΪHBO3��CԪ��ԭ�ӵ������������ȴ�����4��C����������D�������Ӿ�����ͬ�ĵ����Ų�����Ԫ�ؿ��γɻ�����D2C��C��Eͬ���塣
(1)B�����ڱ��е�λ��______________________________________________
(2)FԪ�ص�����������Ӧ��ˮ����Ļ�ѧʽΪ___________________________________��
(3)Ԫ��C��D��E�γɵļ����Ӱ뾶��С�����˳��________________________(�����ӷ��ű�ʾ)��
(4)�õ���ʽ��ʾ������D2C���γɹ��̣�__________________________________________________��
C��D�����γɻ�����D2C2��D2C2�к��еĻ�ѧ����_________________________________________��
(5)C��E���⻯��е��ɸߵ���˳���ǣ�_______________________________��
(6)д��̼������E������������Ӧˮ����Ũ��Һ��Ӧ�Ļ�ѧ����ʽ�����õ����ű������ӵ�ת�Ʒ���_______________����ת�Ƶ���Ϊ0.2molʱ����״���·�Ӧ��������_______________L��
(7)��֪E���ʺ�F���ʵ�ˮ��Һ��Ӧ����������ǿ�ᣬ�����ӷ���ʽΪ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϲ�����������ȥ������������Ҫ�ɷ�ΪFe2O3��FeO��SiO2��Al2O3���������������ʣ� ��ȡ��ˮ������������FeSO47H2O����������ͼ��

��1������������Ҫ�ɷ���_________���ѧʽ����
��2����ԭʱ���Լ�X��ѡ��SO2����Ӧ�����������_________���ѧʽ����
��3���ӷ��������II�����Һ�еõ���Ʒ��Ӧ���еIJ�����_________��_________�����ˡ�ϴ�ӡ�������
��4����ˮ������������FeSO47H2O�� ��ҽѧ�ϳ�������Ѫ����ij����С��ͨ������ʵ�鷽���ⶨij��Ѫ�����������ӵĺ�����
����a��ȡ10Ƭ��Ѫ����Ʒ��ȥ���¡���ĥ���ܽ⡢���ˣ�����Һ���250mL��Һ��
����b��ȡ������Һ25mL����ƿ�У���������ϡ�����ữ���μ�0.0100mol/L��KMnO4��Һ����ǡ����ȫ��Ӧ����¼���ĵ�KMnO4��Һ��������ٶ�ҩƷ�������ɷֲ���KMnO4��Ӧ���������ķ�ӦΪ��MnO4��+5Fe2++8H+=5Fe3++Mn2++4H2O��
����c���ظ�������b��2��3�Σ�ƽ������KMnO4��Һ20.00mL��
�ٲ���a��������Һʱ��Ҫ�IJ����������ձ�����ͷ�ι��⣬����Ҫ_________��_________��
�ڸò�Ѫ�����������ӵĺ���Ϊ_________mg/Ƭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��L-��Ϳ���������ɭ�ۺ�֢�����ƣ���ṹ��ʽΪ 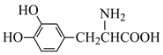 �����й���L-��͵�˵���У�����ȷ����
�����й���L-��͵�˵���У�����ȷ����
A.����ʽΪC9H12O4NB.���������ɸ߷���
C.�����ᡢ�Ӧ������D.�ڿ������ױ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ս��������ᡶ�����������桷�״�д�����ƶ���硢�������ʩ�Ľ���������ͼ��һ�������缫��Ӧ���漰������������ȫ������������Ч�ʿɴ�80%������˵���д������

A. ��װ�ý���ѧ��ת��Ϊ����
B. ���ӽ���Ĥ����H+��OH��ͨ��
C. ����ΪA����缫��Ӧʽ��H2��2e�� + 2OH�� = 2H2O
D. ��ص��ܷ�ӦΪH+ + OH��![]() H2O
H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������X�п��ܺ���FeO��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��KI��
��KI��![]() �е������֡�Ϊȷ���ù����ĩ�ijɷ֣���ȡX��������ʵ�飬ʵ����̼�������ͼ��ʾ��
�е������֡�Ϊȷ���ù����ĩ�ijɷ֣���ȡX��������ʵ�飬ʵ����̼�������ͼ��ʾ��
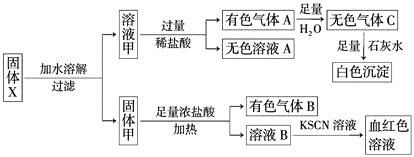
��֪��![]()
![]() �����Ի����¾��н�ǿ��������
�����Ի����¾��н�ǿ��������
![]() ��ɫ��������ˮ�Ҳ������Һ��Ӧ
��ɫ��������ˮ�Ҳ������Һ��Ӧ![]()
��������ʵ�飬����˵���в���ȷ���� ![]()
![]()
A.X��һ������![]() ��
��![]() ��
��![]()
B.X��һ��û��![]() ��KI�����ܺ���
��KI�����ܺ���![]() ��
��![]()
C.X��������FeO��![]() �е�һ��
�е�һ��
D.����Aһ������![]() ��
��![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ���ǣ� ��
A.�ý������˳��ɽ��ͷ�Ӧ��Na(l)+KC1(l)=NaCl(l)+K(g)
B.0.1mol Na2O2������CO2�����ַ�Ӧ��������ת�Ƶĵ�����ĿΪ0.2��6.02��l023
C.�����£���ҵ���ô����ʯӢɰ�Ʋ�����˵�����������ǿ��̼��
D.�����£�NH4C1��Һ��ˮϡ�ͺ���Һ�е�Kwֵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Mg��Cu��ɵ�3.96g�����Ͷ������ϡ������ǡ�÷�Ӧ��������ȫ�ܽ�ʱ���õ�Ψһ�Ļ�ԭ����NO����1.344L(��״��)����Ӧ����Һ�м���2molL-1NaOH��Һ����������ǡ�ó�����ȫ�������ĵ�NaOH��Һ�����Ϊ�� ��
A.60mLB.90mLC.120mLD.150mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Ľṹ��ʽΪ��
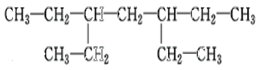
��1�������������ƣ�_________________________
��2����������ij��ϩ���ӳɺ����ɵģ����ϩ���ṹ��________�֡�
��3���������ɵ�Ȳ���ӳɺ����ɵģ����Ȳ���ṹ��________�֡�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com