
【题目】将Mg、Cu组成的3.96g混合物投入适量稀硝酸中恰好反应,固体完全溶解时,得到唯一的还原产物NO气体1.344L(标准状况),向反应后溶液中加入2molL-1NaOH溶液至金属离子恰好沉淀完全.则消耗的NaOH溶液的体积为( )
A.60mLB.90mLC.120mLD.150mL
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法正确的是( )
A.制钛:用金属钠置换氯化钛(![]() )溶液中的钛
)溶液中的钛
B.炼铁:用![]() 在高温下还原铁矿石中的铁
在高温下还原铁矿石中的铁
C.制钠:以海水为原料制得精盐,再电解纯净的![]() 溶液
溶液
D.炼铜:电解精炼黄铜矿得到纯度为99.9%的铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍及其化合物的应用正日益被重视。
(1)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为____________。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有________(填字母)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.铍、镁和铝与氯气形成的化合物晶体类型相同
(3)铍、铝晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点(1551K)比铝的熔点(930K)高,原因是____________________。
(4)BeO立方晶胞如图所示,若BeO晶体的密度为dg·cm-3,则晶胞边长为________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是

A. a和b都属于芳香族化合物
B. a、b和c均能使酸性KMnO4溶液褪色
C. a和c分子中所有碳原子均处于同一平面上
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Z、Q、R、T为前四周期元素,且原子序数依次增大。X和Q属同族元素,X和R可形成化合物XR4;R2为黄绿色气体;Z与X同周期且基态原子的s轨道和p轨道的电子总数相等;T2+的3d 轨道中有5个电子。请回答下列问题:
(1)Z基态原子的电子排布式是______;Z所在周期元素中,最高价氧化物对应的水化物酸性最强的是______(填化学式)。
(2)利用价层电子对互斥理论判断 RZ3-的立体构型是______;RZ3-的中心原子的杂化轨道类型为______。
(3)水中T含量超标,容易使洁具和衣物染色.RZ2可以用来除去水中超标的T2+,生成黑色沉淀TZ2,当消耗0.2molRZ2时,共转移了1mol电子,则反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是
A. 溴化铵的电子式:  B. 次氯酸分子的结构式:H-O-Cl
B. 次氯酸分子的结构式:H-O-Cl
C. 氨气分子的电子式:  D. 氯化钠的分子式:NaCl
D. 氯化钠的分子式:NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1mo1/LHCl溶液滴定10.mL0.1mol·L-1Na2CO3溶液,滴定曲线如图所示。下列说法正确的是( )
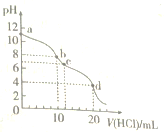
A. 水电离程度由大到小的顺序为:a>b>c>d
B. a点时:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
C. b点时:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D. d点时:c(H+)>c(HCO3-)=c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中具有广泛的用途。请回答下列问题:
(1)氰化物极毒,![]() 可以消除含氰废液中的
可以消除含氰废液中的![]() ,其中
,其中![]() 的电子式为________。
的电子式为________。
(2)碳酸亚铁![]() 是一种重要的工业盐,外观为白色固体,潮湿空气中易被氧化。用硫铁矿烧渣
是一种重要的工业盐,外观为白色固体,潮湿空气中易被氧化。用硫铁矿烧渣![]() 主要含
主要含![]() 、
、![]() 、少量
、少量![]() 制备
制备![]() 的工艺流程如下:
的工艺流程如下:

![]() “还原”时,发生反应的离子方程式为________。
“还原”时,发生反应的离子方程式为________。
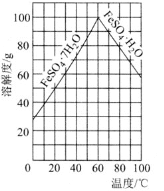
![]() 的溶解度曲线如图所示,欲获得
的溶解度曲线如图所示,欲获得![]() ,采用的实验操作是________。
,采用的实验操作是________。
![]() 在空气中煅烧可制备铁红,反应的化学方程式为________。
在空气中煅烧可制备铁红,反应的化学方程式为________。
![]() “沉淀”步骤中
“沉淀”步骤中![]() 达到沉淀溶解平衡时,若
达到沉淀溶解平衡时,若![]()
![]() ,欲使所得的
,欲使所得的![]() 中不含有
中不含有![]() ,应调节溶液的pH不超过________
,应调节溶液的pH不超过________![]() 已知:
已知:![]() ,
,![]() ,
,![]() 。
。
(3)铁镍电池结构、强度极好,循环寿命和工作寿命长。电池总反应为
![]() 。写出放电时的负极反应式:________。
。写出放电时的负极反应式:________。
(4)化合物![]() 为
为![]() 价
价![]() 为亮绿色晶体,可用于晒制蓝图。其组成测定实验如下:
为亮绿色晶体,可用于晒制蓝图。其组成测定实验如下:
步骤Ⅰ:称取0.491g![]() 置于锥形瓶中,加足量蒸馏水和稀
置于锥形瓶中,加足量蒸馏水和稀![]() ;
;
步骤Ⅱ:用![]()
![]() 溶液进行滴定,恰好反应时消耗
溶液进行滴定,恰好反应时消耗![]() 溶液
溶液![]() ;
;
步骤Ⅲ:再加入适当的还原剂,将![]() 完全转化为
完全转化为![]() ,用
,用![]() 溶液继续滴定,当
溶液继续滴定,当![]() 完全氧化时,消耗溶液
完全氧化时,消耗溶液![]() 溶液2.00mL。
溶液2.00mL。
![]() 步骤Ⅰ中加足量稀
步骤Ⅰ中加足量稀![]() 的目的是________。
的目的是________。
![]() 该化合物的化学式为________。
该化合物的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示(已知pKa=-lgKa),下列说法正确的是
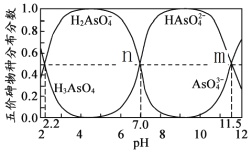
A. H3AsO4溶液pKa2为4.5
B. NaH2AsO4溶液显碱性
C. 常温下,m点对应溶液中由水电离出的OH—浓度为10—11.5 mol/L
D. n点对应溶液中,离子浓度关系:c(HAsO42—)=c(H2AsO4—)>c( OH—) =c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com