
【题目】某校化学实验小组在“探究碘水与FeCl2溶液能否反应”的系列实验中发现:在足量的稀KI溶液中,加入1~2滴FeCl3溶液,振荡后溶液呈黄色。
(查阅资料)
碘微溶于水,碘的水溶液颜色随浓度变化呈现黄色或棕色,碘水中含有碘单质;含Fe3+的溶液也呈黄色。
(提出问题)
Fe3+、I2的氧化性强弱情况。
(提出猜想)
(1)甲同学认为氧化性I2>Fe3+,故上述实验现象不是发生化学反应所致,则溶液呈黄色是因为含______;乙同学认为氧化性Fe3+>I2,故上述实验现象是发生化学反应所致,则溶液呈黄色是因为含_______。
(设计实验并验证)
(2)为验证乙同学的观点正确,丙同学选用下面所提供的试剂设计出以下两种方案进行实验,请完成下列表格。供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
试剂 | 实验现象 | |
方案1 | ____________ | ______ |
方案2 | ______ | _________ |
(实验结论)
氧化性:Fe3+>I2。
(拓展应用)
(3)①根据上述实验推测,若在FeI2溶液中通入氯气,首先被氧化的离子是________。
②在100mL FeI2溶液中通入2.24LCl2(标准状况下),溶液中若有![]() 的Fe2+ 被氧化,用离子方程式表示该反应过程:___。
的Fe2+ 被氧化,用离子方程式表示该反应过程:___。
【答案】含Fe3+ 含I2 b 四氯化碳层呈紫色 d 溶液不变红 I― 2Fe2++6I―+4Cl2==3I2+2Fe3++8Cl―
【解析】
(2)不是发生化学反应所致,根据微粒的颜色判断,根据Fe3+在水中的颜色来猜想;发生化学反应,发生氧化还原反应生成碘,根据碘水的颜色来进行猜想;
(3)利用Fe3+的检验及萃取来进行实验的设计,Fe3+遇KSCN溶液变为红色,碘易溶于四氯化碳中,且四氯化碳与水不溶;
(5)①FeI2在溶液中电离出Fe2+、I-,Cl2通入FeI2溶液中,既能氧化Fe2+,又能氧化I-,根据氧化性:Fe3+>I2,因此Cl2先氧化I-,后氧化Fe2+;
②根据电子守恒进行计算。
(2)Fe2+的颜色:浅绿色,Fe3+的颜色:棕黄色,碘微溶于水,碘的水溶液颜色随浓度变化呈现黄色或棕色,氧化性I2>Fe3+,故上述实验现象不是发生化学反应所致,Fe3+在水中为黄色,溶液呈黄色是因为含有Fe3+所致,发生化学反应所致,因碘水的颜色为黄色,氧化性:Fe3+>I2,则发生2Fe3++2I-=2Fe2++I2则溶液呈黄色是因为含有I2所致,
故答案为:Fe3+;I2;
(3)因Fe3+遇KSCN溶液变为红色,碘易溶于四氯化碳中,且四氯化碳与水不溶,则
实验操作 | 实验现象 | |
方案1 | 取少量上述黄色溶液于试管中,加入 KSCN溶液,振荡,静置 | 溶液呈红色 |
方案2 | 取少量上述黄色溶液于试管中,加入四氯化碳,振荡,静置 | 液体分层,下层呈紫红色 |
,
故答案为:
KSCN溶液 | 溶液呈红色 | |
取少量上述黄色溶液于试管中,加入四氯化碳,振荡,静置 | 液体分层,下层呈紫红色 |
(5)①FeI2在溶液中电离出Fe2+、I-,Cl2通入FeI2溶液中,既能氧化Fe2+,又能氧化I-.发生的反应为2Fe2++Cl2═2Fe3++2Cl-、2I-+Cl2═I2+2Cl-,根据氧化性:Fe3+>I2,因此Cl2先氧化I-,后氧化Fe2+,
故答案为:I-;
②FeI2在溶液中电离出Fe2+、I-,Cl2通入FeI2溶液中,先氧化I-,后氧化Fe2+;2.24LCl2(标准状况下),转移的电子数为2.24L÷22.4 L/mol×2×1=0.2mol
设FeI2的物质的量浓度为c,
由电子守恒可知0.2mol=c×0.1L×2+c×0.1L×2/3
解得c=0.75mol/L,
在100mLFeI2溶液中,被氧化的碘离子的物质的量为0.15mol,被氧化的亚铁离子的物质的量为0.05mol,参加反应的氯气的物质的量为0.1mol,
则n(Fe2+):n(I-):n(Cl2)=0.05mol:0.15mol:0.1mol=1:3:2,发生的离子反应为:2Fe2++6I-+4Cl2=2Fe3++3I2+8Cl-,
故答案为:2Fe2++6I-+4Cl=2Fe3++3I2+8Cl-


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是( )
A. 选择合适的试剂,用图1装置可分别制取和收集少量CO2、NO 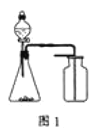
B. 除去石英(主要成分SiO2)中少量碳酸钙:用稀盐酸溶解后过滤
C. 洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干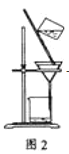
D. 用广泛pH试纸测得0.1molL-1NH4Cl溶液的pH=5.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.从铁、盐酸、氧气、水、硝酸银溶液五种物质中选出一种或两种作为反应物,按下列反应类型各写一个化学方程式:
(1)化合反应___。
(2)置换反应___。
Ⅱ.按下列要求各写出一个化学反应的化学方程式(反应物自选):
(1)有水生成的化合反应___。
(2)由硝酸银生成硝酸铜的置换反应__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石和石墨均为碳的同素异形体,它们燃烧时,若氧气不足生成一氧化碳,若充分燃烧生成二氧化碳,反应中放出的热量如图所示。
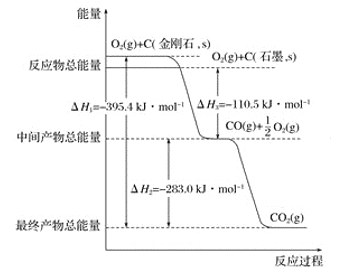
(1)等质量的金刚石和石墨完全燃烧,____________(填“金刚石”或“石墨”)放出的热量更多,写出表示石墨完全燃烧的热化学方程式:_______________________________________
(2)在通常状况下,____________(填“金刚石”或“石墨”)更稳定,写出石墨转化为金刚石的热化学方程式: _______________________________________________________________。
(3)12 g石墨在一定量空气中燃烧,生成气体36 g,该过程中放出的热量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有FeO、Fe2O3的混合物若干克,在足量H2气流中加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解, 至少需要1molL﹣1的盐酸的体积为( )
A. 0.05 LB. 0.1 LC. 0.2 LD. 1 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制NaOH溶液和硫酸溶液。
Ⅰ、配制100mL 1.0mol·L-1 NaOH溶液

(1)如图所示的仪器中E的名称为___,配制溶液肯定不需要的仪器是___(填序号),还需增加的玻璃仪器有___(填仪器名称)。
(2)在配制NaOH溶液时
①根据计算用托盘天平称取NaOH的质量为___g。
②下列操作对所配溶液浓度的影响是(填“偏高”“偏低”“无影响”)。
操作 | 浓度影响 |
用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了 | ___ |
没有洗涤烧杯和玻璃棒 | ___ |
定容时,仰视读数 | ___ |
容器E未干燥,残余少量水 | ___ |
Ⅱ、配制100mL 0.5mol·L-1 硫酸溶液
用质量分数为98%,密度为1.84g·cm-3的浓硫酸来配制该溶液,该浓硫酸物质的量浓度为___mol·L-1,所需浓硫酸的体积为___mL (计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,等体积的NH3和CH4两种气体,下列有关说法错误的是
A.所含分子数目相同B.所含氢原子物质的量之比为3∶4
C.质量之比为16∶17D.密度之比为17∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二锰(Mn2O3)在现代工业上应用广泛。以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料制备高纯度硫酸锰进而制备三氧化二锰的工艺流程如下(两种矿物中均不存在单质杂质):
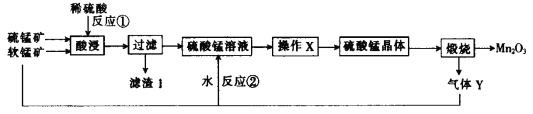
(1)MnS、Mn2O3、MnO2中锰元素的化合价均不同,已知锰有多种化合价,请再写出两种含锰且锰的化合价不同的化合物的化学式:______________。
(2)滤渣1中存在一种非金属单质,则“酸浸”时反应①的化学方程式为________________。
(3)操作X为蒸发浓缩、________、________、洗涤烘干。经操作X之后得到MnSO4H2O。在洗涤操作中,常用酒精洗涤MnSO4H2O晶体,主要目的是_______________________。
(4)气体Y直接排放会污染空气,将Y的水溶液与软锰矿反应可得硫酸锰,反应②的化学方程式为______。
(5)Mn2O3与MnO2类似,也能与浓盐酸反应,其反应的离子方程式为____________。
(6)用标准的BaCl2溶液测定样品中MnSO4H2O的质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其原因可能是_________________(任写一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)前四周期中的一部分如图,若B元素原子序数为x,则A、C、D、E原子序数之和为(________________)
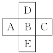
(2)核内中子数为N的R2+,质量数为A,则它的n g氧化物中所含质子的物质的量是(______)mol
(3)最外层电子数为2的元素有 _______ (填元素符号,下同)。
最外层电子数与次外层电子数相等的元素有________
(4)在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是____ 、 ____ 、 ____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com