
| 催化剂 |
| △ |
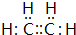 ,故答案为:
,故答案为: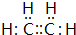 ;
;| 催化剂 |
| Cu |
| △ |
 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,| 催化剂 |
| Cu |
| △ |
 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
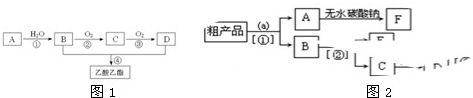
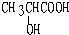 ).在浓硫酸存在下,A可发生如图所示的反应.
).在浓硫酸存在下,A可发生如图所示的反应.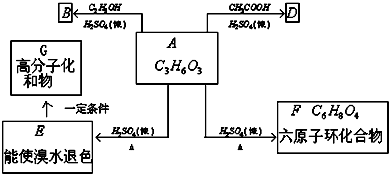
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCOOCH2CH2CH3 |
| B、CH3COOCH2CH3 |
| C、CH3CH2COOCH3 |
| D、HOCH2CH2CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH溶液起始读数 | NaOH溶液终点读数 | |
| 第一次 | 0.10mL | 18.60mL |
| 第二次 | 0.20mL | 18.50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+ |
| B、Mg2+ |
| C、Na+ |
| D、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x+y<z |
| B、B的转化率降低 |
| C、该反应的平衡常数变小 |
| D、逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com