
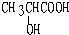 ).在浓硫酸存在下,A可发生如图所示的反应.
).在浓硫酸存在下,A可发生如图所示的反应.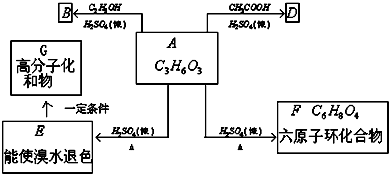
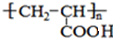 ,A在浓硫酸作用下发生自身酯化反应生成F,F的结构简式为
,A在浓硫酸作用下发生自身酯化反应生成F,F的结构简式为 ,据此分析解答.
,据此分析解答.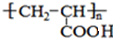 ,A在浓硫酸作用下发生自身酯化反应生成F,F的结构简式为
,A在浓硫酸作用下发生自身酯化反应生成F,F的结构简式为 ,
,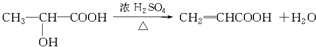 ,A发生自身酯化反应生成F,反应方程式为
,A发生自身酯化反应生成F,反应方程式为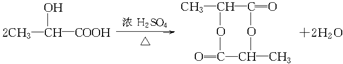 ,
, ;
; ;
;

科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、仅根据实验①能说明还原性:Br->Cl- |
| B、仅根据实验②能说明氧化性:Br2>I2 |
| C、上述实验验证了Cl2、Br2、I2的氧化性相对强弱 |
| D、向实验③所得溶液中加CCl4,充分振荡,下层为橙红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
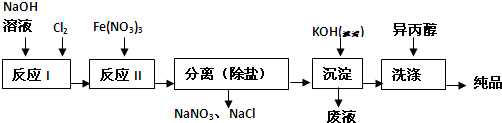
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
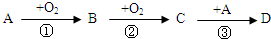
查看答案和解析>>
科目:高中化学 来源: 题型:
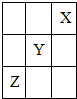 短周期元素X,Y,Z在周期表中的位置如图所示,则下列说法中错误的是( )
短周期元素X,Y,Z在周期表中的位置如图所示,则下列说法中错误的是( )| A、X,Y,Z中X的单质最稳定 |
| B、Y的氢化物为HY |
| C、Y与水反应能生成HYO |
| D、Z的最高价氧化物的水化物是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
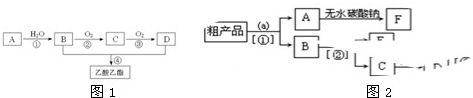
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com