
| A、5~9 |
| B、4.0~10.0 |
| C、4.3~9.7 |
| D、以上都不正确 |
| 2×10-5mol |
| 0.1L+0.1L |
| 2×10-5 |
| 0.2001 |
| 1×10-14 |
| 1×10-4 |


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
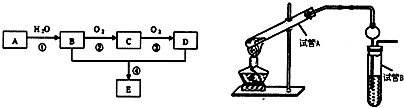
| 光照 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 |
| B、充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4H2O |
| C、放电时每转移3 mol电子,正极有1 mol K2FeO4被还原 |
| D、充电时阴极溶液的碱性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在稀溶液中,1mol酸和1mol碱完全反应所放出的热量,叫作中和热 |
| B、在101kpa时,1mol物质燃烧时所放出的热量叫作该物质的燃烧热 |
| C、热化学方程式中,各物质前的化学计量数不表示分子个数 |
| D、已知S(s)+O2(g)=SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2,则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素C在周期表中的位置是第三周期第ⅤA族 |
| B、在等体积、等pH的X、Y溶液中分别加入等质量的锌粉,充分反应后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X<Y |
| C、由A、B、C、D四种元素形成的化合物一定只有共价键 |
| D、25℃时,将W溶液与Y溶液等体积混合,充分反应后若pH=7则c(W)>c(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:
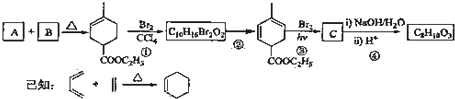
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体质量 | B、气体的物质的量 |
| C、分子总数 | D、原子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com