
 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O Cl2↑+MnCl2+2H2O中,氯元素的化合价从-1价升高到0价,失去电子,被氧化,因此氯化氢是还原剂。Mn元素的化合价从+4价降低到+2价,得到电子,被还原,所以二氧化锰是氧化剂。氯气有毒,需要尾气处理,氢氧化钠溶液能吸收氯气,反应的离子方程式为Cl2+2 OH-=Cl-+ ClO-+H2O。
Cl2↑+MnCl2+2H2O中,氯元素的化合价从-1价升高到0价,失去电子,被氧化,因此氯化氢是还原剂。Mn元素的化合价从+4价降低到+2价,得到电子,被还原,所以二氧化锰是氧化剂。氯气有毒,需要尾气处理,氢氧化钠溶液能吸收氯气,反应的离子方程式为Cl2+2 OH-=Cl-+ ClO-+H2O。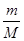 可知,17.4gMnO2的物质的量=17.4g÷87g/mol=0.2mol。在反应中Mn元素的化合价从+4价降低到+2价,得到2个电子,所以0.2mol二氧化锰得到0.4mol电子,因此转移电子的个数是0.4 NA。
可知,17.4gMnO2的物质的量=17.4g÷87g/mol=0.2mol。在反应中Mn元素的化合价从+4价降低到+2价,得到2个电子,所以0.2mol二氧化锰得到0.4mol电子,因此转移电子的个数是0.4 NA。

 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源:不详 题型:填空题
 6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。
6Cu+SO2,该反应的氧化剂是___________________;当生成19.2gCu时,反应中转移的电子为____________mol。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NF3是氧化剂,H2O是还原剂 |
| B.还原剂与氧化剂的物质的量之比为2:1 |
| C.若生成0.2mol HNO3,则转移0.2mol电子 |
| D.NF3在潮湿的空气中泄漏会产生红棕色气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1∶6 | B.1∶7 | C.1∶8 | D.1∶9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( ) )mol
)mol| A.①④ | B.②③ | C.①③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 MnCl2 + Cl2↑ + 2H2O。
MnCl2 + Cl2↑ + 2H2O。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaNO2发生氧化反应 |
| B.NH4Cl中的氮元素被还原 |
| C.N2既是氧化产物,又是还原产物 |
| D.每生成1mol N2转移电子的物质的量为6mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com