
【题目】实验是化学研究的重要方法之一,某同学为了制备氯气并探究氯气等物质的相关性质,设计如图所示的实验方案:

(1)A装置的分液漏斗里盛装浓盐酸,烧瓶里固体为重铬酸钾(K2Cr2O7),还原产物是CrCl3,写出A中离子方程式:__________。
(2) B装置有几个作用,分别是除去氯气中的氯化氢、__________。拆去a导管的后果可能是_________________。
(3)装置C的功能是探究有氧化性的物质是否一定有漂白性,下列最佳试剂组合是______。
① | ② | ③ | ④ | |
I | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
II | 碱石灰 | 浓琉酸 | 硅胶 | 氯化钠 |
III | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
(4)证明溴的非金属性比碘强的实验操作和现象是_____________。
(5)D装置进行实验时存在明显不足,它是_________,合适的溶液X是________(从①氢氧化钠溶液②业硫酸钠溶液③亚硫酸氢钠溶液④氯化亚铁溶液⑤硫氢化钠溶液⑥碳酸氢钠溶液中选择)。
【答案】(l)Cr2O72-+l4H++6Cl-==2Cr3++3C12↑+7H2O(2分)
(2)作安全瓶,检测实验过程中装置是否堵塞(2分)浓盐酸不能顺利滴入烧瓶(2分)
(3)②(2分) (4)实验完毕,打开活塞b,使少量液体流入锥形瓶,关闭活塞,振荡锥形瓶,静罝分层,下层液体呈紫红色(2分)
(5)没有排除氯气对溴单质与KI反应的干扰 (2分) ①④⑥ (2分)
【解析】
试题分析:(1)装置A中制备氯气,离子反应方程式为:Cr2O72-+14H++6Cl-=2Cr3++7H2O+3Cl2↑;
(2)根据装置图,推知实验目的是制备氯气探究氯气的性质以及卤素之间的置换;B装置的作用:饱和食盐水减少氯气的溶解,以及除去氯气中的氯化氢,同时还起安全瓶的作用,防止实验过程中发生堵塞,出现危险;导管a的作用是使烧瓶中的压强与分液漏斗中的压强相等,有利于液体顺利滴下,如果拆去a管,很有可能烧瓶中气体压强大,分液漏斗中液体不能顺利滴下;
(3)探究Cl2的漂白性,干燥的氯气不具有漂白性,湿润的氯气具有漂白性,①碱石灰能和氯气反应,吸收氯气,不能用碱石灰干燥氯气,故错误;②从B装置中出来的氯气还有少量水蒸气,能使干燥的红纸条褪色,经浓硫酸后,转变成干燥的氯气,不能使干燥的红纸条褪色,能够达到实验目的,故正确;③干燥的白纸条,颜色现象不明显,故错误;④氯化钠不具有干燥性,故错误;
(4)打开活塞b,使少量液体流入锥形瓶中,碘单质易溶于四氯化碳,且四氯化碳的密度大于水,碘在四氯化碳层显紫红色,因此下层液体呈紫红色,说明溴的非金属性强于碘,操作是:实验完毕,打开活塞b,使少量液体流入锥形瓶,关闭活塞,振荡锥形瓶,下层液体呈紫红色;
(5)可能氯气溶于溴化钠中,干扰后续实验,因此不足是:有排除氯气对溴单质与KI反应的干扰,①Cl2+2NaOH=NaCl+NaClO+H2O,可以除去氯气,故正确;②Cl2+SO32-+H2O=2Cl-+SO42-+2H+,生成H+再和SO32-反应生成SO2,污染空气,故错误;③H2O+Cl2+HSO3-=2Cl-+SO42-+3H+,产生H+和HSO3-反应生成SO2,污染空气,故错误;④Cl2+2Fe2+=2Cl-+2Fe+,故正确;⑤Cl2+HS-=2Cl-+S↓+H+,产生H+和HS-反应生成H2S气体,有毒,污染空气,故错误;⑥Cl2+H2O![]() HCl+HClO,HCl+NaHCO3=NaCl+H2O+CO2↑,故正确。答案选①④⑥。
HCl+HClO,HCl+NaHCO3=NaCl+H2O+CO2↑,故正确。答案选①④⑥。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.碳酸钙溶于醋酸:CaCO3+2H+![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
B.澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-![]() CaCO3↓+H2O
CaCO3↓+H2O
C.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O![]() AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
D.氯化亚铁溶液中通入氯气:2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压,甲容器中CO2气体与乙容器中CO气体所含的原子总数相等,则甲乙两容器的体积比为( )
A.1:2 B.2:1 C.3:2 D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2C+O2===2CO的能量变化如下图所示。下列说法正确的是

A.12g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ
B.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
C.该反应的热化学方程式是2C(s)+O2(g)===2CO(g);ΔH=-221 kJ
D.该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法在化学科学中起着非常重要的作用,下列各组物质中,在物质分类中,前者从属于后者的一组是
A.金属,化合物 B.金属氧化物,碱性氧化物
C.泥沙,胶体 D.单质,纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知空气﹣锌电池的电极反应为锌片:Zn+2OH﹣﹣2e﹣=ZnO+H2O;碳棒:O2+2H2O+4e﹣=4OH﹣ , 据此判断,锌片是( )
A.正极,被还原
B.正极,被氧化
C.负极,被还原
D.负极,被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

某学生实验需要450mL 0.2mol/L的稀H2SO4,实验员老师准备取用这批硫酸来配制。
可供选用的仪器有:a.胶头滴管;b.烧瓶;c.烧杯;d.药匙; e.量筒;f.托盘天平。
请回答下列问题:
(1)该校所购买的这批硫酸的物质的量浓度为 ;
⑵需要用量筒量取上述浓硫酸的体积为 mL,量取浓硫酸时应选用(填序号) 规格的量筒。
a.10 mL b.50 mL c.100 mL
⑶上述仪器中不需要使用的有(选填序号) ,还缺少的仪器有(写仪器名称) 。
⑷若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①硫酸溶解后未冷至室温即进行定容 ;②定容时俯视刻度线 ;
⑸定容时液面高于刻度线应采取的措施是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含有Al2O3、Fe2O3等杂质的铬铁矿[主要成分为Fe(CrO2)2]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下:

己知:铬铁矿在空气中与纯减煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,
且 Al2O3+Na2CO3![]() 2NaAlO2+ CO2↑。请回答:
2NaAlO2+ CO2↑。请回答:
(1)在铬铁矿Fe(CrO2)2中,Cr的化合价为___________。
(2)滤渣2的成分为_____________。
(3)将滤渣1放入稀硫酸溶解后得溶液W,检验该溶液中金属离子的方法是_________。
(4)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol/L以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:
加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于________________mol/L,后续废水处理方能达到国家排放标准。
②还原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。写出酸性条件下CrO42-与绿巩在溶液中反应的离子方程式:_________________________________。
Cr(OH)3。写出酸性条件下CrO42-与绿巩在溶液中反应的离子方程式:_________________________________。
(5)某高效净水剂是由K2FeO4得到的,工业上以溶液w、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的离子方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是课外活动小组的同学设计的 4 个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
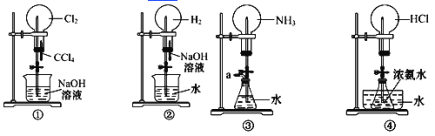
A.挤压装置①的胶头滴管使 CCl4。全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使 NaOH 溶液全部进入烧瓶,片刻后打开止水夹
C.用鼓气装置从装置③的 a 处不断鼓入空气并打开止水夹
D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com