
【题目】100mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol·L-1,c(Cl-)为1.3mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加2mol·L-1NaOH溶液的体积为
A. 40mL B. 72mL C. 80mL D. 128mL
【答案】C
【解析】
溶液中n(Cl-)=0.1L×1.3mol/L=0.13mol,溶液中n(Mg2+)=0.2mol/L×0.1L=0.02mol,
根据电荷守恒,溶液中3n(Al3+)+2 n(Mg2+)= n(Cl-),n(Al3+)=![]() =0.03mol,将100mL此溶液中的Mg2+转化为Mg(OH)2沉淀并分离析出,氢氧化钠一定过量,铝离子全部转化为AlO2-,所以反应后溶液为NaCl、NaAlO2的混合液,由原子守恒可知n(NaOH)=n(Na)=n(Cl)+n(Al)=0.13mol+0.03mol=0.16mol,所以至少需要2mol/L氢氧化钠溶液的体积为
=0.03mol,将100mL此溶液中的Mg2+转化为Mg(OH)2沉淀并分离析出,氢氧化钠一定过量,铝离子全部转化为AlO2-,所以反应后溶液为NaCl、NaAlO2的混合液,由原子守恒可知n(NaOH)=n(Na)=n(Cl)+n(Al)=0.13mol+0.03mol=0.16mol,所以至少需要2mol/L氢氧化钠溶液的体积为![]() =0.08L=80mL,故C正确,
=0.08L=80mL,故C正确,
故选C。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是:
A. 氢氧化铝与稀硝酸反应:H+ + OH- = H2O
B. MgCl2溶液与氨水反应: Mg2+ + 2NH3·H2O = Mg(OH)2↓+2NH![]()
C. CuCl2溶液与铁粉反应: 3Cu2+ + 2Fe =3Cu + 2Fe3+
D. 锌与CH3COOH溶液反应:Zn + 2H+ = Zn2++ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝的碱式碳酸盐是中和胃酸药物的主要成分。欲测定某种镁和铝的碱式碳酸盐的成分进行了以下实验,根据以下实验记录,回答下列问题:
(1)称取6.02g该碱式碳酸盐,加入4.0mol/L盐酸使其溶解,当加入42.5mL时开始产生CO2,当加入盐酸至45.0mL时恰好完全溶解,该碱式碳酸盐中OH-与CO32- 的物质的量之比n(OH-)︰n(CO32-)=__________;
(2)在上述碱式碳酸盐恰好完全溶解所得溶液中加入过量的NaOH溶液,过滤,干燥(不分解)后得3.48g沉淀物。若该碱式碳酸盐中镁元素与氢元素的质量分数之比为6:1,试计算确定该碱式碳酸盐的化学式 __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
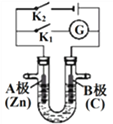
(1)断开K2,闭合K1,若所盛溶液为AgNO3溶液:则A为________极,B(石墨)极的电极反应式为________________。若所盛溶液为海水:则B极的电极反应式为______________________
(2)断开K1,闭合K2,若所盛溶液为滴有酚酞的NaCl溶液,则:
A电极附近可观察到的现象是___________________________________,
检验B电极上产生的物质的方法_________________________________________,
该装置中发生的反应化学方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方式正确的是( )
A. H2气体中含有少量的CO2杂质可以通过灼热的炭粉除去
B. CO2气体中含有的少量HCl杂质可通过饱和Na2CO3溶液除去
C. K2CO3固体中含有少量的NaHCO3杂质可用加热的方式提纯
D. NaOH溶液中含有少量的Ba(OH)2可加入适量的Na2SO4过滤除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)
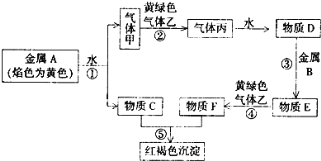
请回答下列问题:
(1)A的化学式为_____________,丙的化学式为_____________;
(2)写出下列反应的离子方程式:
①________________________
④_________________________
⑤________________________ 。
(3)写出C溶液与Al反应的离子方程式____________________。
(4)为鉴定B单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是_____________。
A. 碘水 B. NaOH溶液 C. KSCN溶液 D. Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是自然界碳循环中的重要物质。下列过程会引起大气中CO2含量上升的是
A. 光合作用 B. 自然降雨
C. 化石燃料的燃烧 D. 碳酸盐的沉积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是________。
第1组 | 第2组 | 第3组 |
S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:(熔点:SO2 -76.1 ℃,SO3 16.8 ℃;沸点:SO2 -10 ℃,SO3 45 ℃)
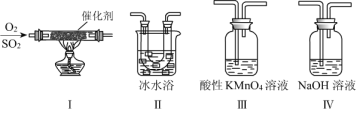
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是__________________。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是_____________________;装置Ⅳ的作用是_________________。
③装置Ⅲ中溶液逐渐褪色,说明SO2具有__________性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 甲苯既可使溴的CCl4溶液褪色,也可使KMnO4酸性溶液褪色
B. 有机物![]() 的消去产物有2种
的消去产物有2种
C. 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2===CH—COOCH3
D. 可用溴水鉴别直馏汽油、四氯化碳和乙酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com