
【题目】设阿伏加德罗常数的数值为NA,下列说法正确的是
A.1L 1 mol·L-1 的NaHCO3溶液中含有的离子数为3NA
B.22.4 L的CO2与过量Na2O2充分反应转移的电子数为NA
C.常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
D.常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】合成具有美白作用的化妆品原料Z的反应原理如下:
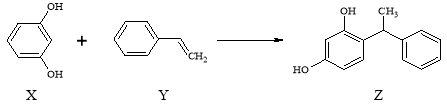
下列叙述不正确的是( )
A.X、Z均能与Na2CO3 溶液反应
B.X可作缩聚反应单体,Y可作加聚反应单体
C.X、Y、Z 均能使溴水褪色,但是原理不完全相同
D.该反应的反应类型为取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将0.6 mol A和0.5 mol B充入0.4 L密闭容器中发生2A(g)+B(g)![]() mD(g)+E(g),经过5 min后达到化学平衡,此时测得D为0.2 mol。又知5 min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )
mD(g)+E(g),经过5 min后达到化学平衡,此时测得D为0.2 mol。又知5 min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )
A. A、B均转化了20% B. m值为2
C. 该温度下,反应的平衡常数K为1.33L·mol-1 D. 平衡时混合物总物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定草酸晶体(H2C2O4xH2O)中的x值,进行如下实验
(1)称取Wg草酸晶体,配成100.00mL溶液
(2)取25.00mL所配溶液于锥形瓶内,加入适量稀H2SO4后,用浓度为amolL-1的KMnO4溶液滴定至KMnO4不再褪色为止,所发生的反应为:2KMnO4+5H2(C2O)4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
①实验中,不需要的仪器有(填序号)_______________
A、托盘天平(带砝码、镊子) B、滴定管 C、100mL的量筒
D、100mL的容量瓶 E、烧杯 F、漏斗 G、锥形瓶 H、玻璃棒
I、药匙 J、烧瓶
②实验中,标准液KMnO4溶液应装在_______式滴定管中,因为________________
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,则所测得的x的值会_________(填偏大、偏小、无影响).
④在滴定过程中若用去amolL-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为_____________molL-1,由此,x=_____________ .
⑤若滴定终点读数时俯视刻度,则计算的x值会_______(填偏大、偏小、无影响).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。 水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是_________________________。
(2)已知:20℃时溶解度/g
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
则步骤Ⅰ中加入Na2CO3可除去水垢中的______________________。
(3)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有____________________________。
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因__________________。
(4)步骤Ⅲ中,加入Na2SO3的目的是______________________。(结合离子方程式用文字表达)
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜。
①完成并配平其反应的离子方程式:
____Fe+____NO2-+____H2O=______N2↑+__________+_______。
②如果有16.8 g铁被钝化,则转移的电子数为___________________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当今环境问题越来越受到人们的重视。汽车尾气中含有较多的NO和CO,两种气体均会使人体中毒。处理大气中的污染物,打响“蓝天白云”保卫战是当前的重要课题。请回答下列问题
(1)用还原法将NO转化为无污染的物质。已知:
2C(s)+O2(g)![]() 2CO △H1=-221.0KJ/mol
2CO △H1=-221.0KJ/mol
N2(g)+O2(g)![]() 2NO △H2=+180.5KJ/mol
2NO △H2=+180.5KJ/mol
2NO+C(s)![]() CO2(g)+N2(g) △H3=-573.75KJ/mol
CO2(g)+N2(g) △H3=-573.75KJ/mol
请写出CO与NO生成无污染气体CO2与N2的热化学方程式_______________________。
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器的反应温度分别为T甲= 500℃、T乙= 500℃、T丙= a℃
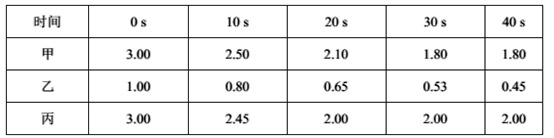
甲容器中,该反应的平衡常数K=_______。丙容器的反应温度a _______500℃(填“”、“<”或“=”),理由是_______________________________。
(3)某研究性小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。
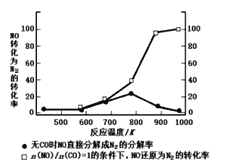
①若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为_________。
②在n(NO)/n(CO)=1的条件下,为更好的除去NO物质,应控制的最佳温度在_____K左右。
(4)利用电解原理也可以处理NO。下图为工业生产模拟装置。其中A、B为多孔电极(外接电源未画出),则B为___________极(填“正”“负”“阴”或“阳”,),A电极反应式为______________________。
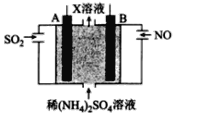
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,合理的是( )。

A. 图①:验证H2CO3酸性强于H2SiO3 B. 图②:收集CO2或NH3
C. 图③:分离Na2CO3溶液与CH3COOC2H5 D. 图④:分离C2H5OH与CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷结构为立方体,分子式为C8H8,其熔点比相同碳原子的辛烷高,立方烷的结构简式如图所示。下列有关立方烷的说法正确的是( )
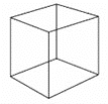
A.其一氯代物只有1种,二氯代物有2种
B.常温常压下为气体
C.与乙苯(结构简式为![]() )是同分异构体
)是同分异构体
D.与苯的含碳质量分数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com